|
РОССИЙСКАЯ АКАДЕМИЯ НАУК
Государственный научный центр РФ - Институт медико-биологических проблем
Оганов В.С.
Москва
ОКТЯБРЬ 2004
Человек иногда спотыкается об истину, но
чаще всего ему удается удержать баланс
и он проходит мимо.
У. Черчилль
Введение
Актовая лекция в день 41-й годовщины образования Института - предприятие,
столь же почетное, сколь и ответственное. История такого уникального образования
как наш Институт - это не просто вехи времени. Это, конечно же, та сумма
новых знаний в области науки, впервые на наших глазах открывшаяся человечеству.
Многолетняя, почти вровень с возрастом Института, моя работа в нем дает
мне право, смею надеяться, гордиться причастностью к тем фундаментальным
научным результатам, которых Институт достиг за это время и которые являются
основополагающими для современной гравитационной физиологии и космической
медицины. Работая, я старался по мере сил внести свой вклад в достижения
Института. В частности, приведенный выше эпиграф содержит намек на всегда
присутствующее сомнение относительно того, насколько удалось "не
пройти мимо" истины. Я лишь взял на себя смелость кратко представить
результаты наших (совместно с сотрудниками лаборатории) теоретических
и экспериментальных исследований в стенах Института в историческом аспекте.
История приобщения недавнего выпускника медицинского института к проблеме
гравитационной физиологии началась осенью 1960 года работой в качестве
научного сотрудника физиологического отдела Летно-испытательного института
(ЛИИ) в г. Жуковском. Здесь я впервые увидел трудности, но и одновременно
почувствовал романтику работы летчиков-испытателей - мужественных и простых
рыцарей неба. Не меньшее уважение вызывали и обследуемые в нашем отделе
испытатели конкретной космической техники, в частности - прототипа катапультного
кресла, которым вскоре воспользовался при возвращении на Землю первый
космонавт планеты - Ю.А.Гагарин.
Эта работа проходила в составе команды уже опытных авиационных врачей,
которые представляли Государственный научно-исследовательский испытательный
ордена Красного Знамени институт авиационной и космической медицины ВВС
(ГНИИОКЗИАКМ), а именно отдел, возглавляемый уже известным ученым и деликатнейшим
человеком - д.м.н. С.А.Газуловым. Они-то и пригласили меня в свой Институт.
Здесь в физиологическом отделе авиационного института я уже проходил научную
школу под руководством хорошо известных ученых - будущего академика О.Г.Газенко,
профессоров П.В.Васильева, Ф.Д.Горбова, Н.Н.Гуровского и моего ближайшего
сотрудника и друга до настоящего времени - доктора Г.Д.Глода.
Здесь же судьба свела меня с большой группой сверстников - военных врачей,
дружба с которыми сохранилась и по сей день (А.Киселев, Е.Ильин, В.Корольков,
С.Николаев). К несчастью о некоторых из друзей-соратников того времени
осталась лишь светлая память (Б.Егоров, Ю.Сенкевич, А.Сгибнев, Л.Баядин,
Б.Юров).
По-видимому, как "подающего надежды ученика" меня в 1963 году
направили в целевую аспирантуру при кафедре клинической и экспериментальной
физиологии ЦОЛИУВ, которую я завершил защитой кандидатской диссертации
(1966), работая уже год во вновь организованном Институте космической
биологии и медицины (ныне ГНЦ РФ - ИМБП РАН).
Я пришел тогда в подразделение Б.Егорова с определенными представлениями
о предмете исследований в области гравитационной физиологии. Дело в том,
что в аспирантуре мои электрофизиологические исследования как раз касались
скелетной мускулатуры (т.н. пластический тонус мышц) и состояние (вызванные
потенциалы) высших подкорковых центров (substantia nigra, corpus striatum
и др.), имеющих непосредственное отношение к организации движений [Шаповалова,
2004].
На этих основаниях и из ретроспективного анализа литературы по эволюционной
и сравнительной физиологии складывалось убеждение, что опорно-двигательный
аппарат (ОДА), как анатомическое образование и, вместе с тем, как единая
структурно-функциональная биомеханическая система, эволюционирующая в
поле земного тяготения, может стать главной мишенью, где в первую очередь
могут проявиться эффекты невесомости.
1. Эволюция костно-мышечной системы и гравитация
Костный скелет и его масса, форма и функция отдельных элементов костно-мышечной
системы, макро- и микроструктура костной ткани и принципы мышечного сокращения
- все это в общем виде не что иное, как одно из проявлений "гравитационной
памяти" и структурного следа, оставленного миллионами лет эволюции
живых систем в гравитационном поле Земли.
Связь эволюции костно-мышечной системы и гравитации естественно рассматривать
как частный случай взаимосвязи (единства) организма и внешней среды. Этот
постулат неоднократно подчеркивался большинством ученых-эволюционистов
начиная с Ж.Ламарка (1805) и Ч.Дарвина (1859). В этом контексте следует
упомянуть работы И.М.Сеченова и В.Крукса, А.Н.Северцова и В.И.Вернадского,
И.М.Шмальгаузена и, конечно, К.Э.Циолковского и Ф.Вента. В ряду абиотических
факторов внешней среды роль сил гравитации представляется большинству
из упомянутых исследователей как наиболее фундаментальная.
Происхождение и развитие костной ткани тесно связаны с эволюцией одной
из ее филогенетически более древней функции - метаболической, играющей
основную роль в регуляции кальциевого обмена [Румянцев, 1958] и зародившейся
еще в водной среде. Этот вопрос подробно рассмотрен ранее [Оганов, 2003].
Поэтому в Актовой лекции мы кратко рассмотрим данные об эволюции костно-мышечной
системы животных лишь со времени смены их водной среды обитания на сушу.
Этим начинается принципиально новый этап развития костно-мышечной системы,
поскольку именно здесь и в наибольшей степени одним из главных неизменных
факторов внешней среды выступает гравитация. Ее роль в виде механических
нагрузок разного типа в наибольшей мере прослежена в эволюции костной
ткани для различных уровней ее организации [Бровар, 1960; Коржуев, 1971;
Carter et al., 1991].
Внешне наиболее заметна эволюция опорной функции, которая проявляется
в усложнении формы костных структур и геометрии скелета у наземных животных.
Здесь участие законов механики в адаптивной эволюции костей подтверждается
наличием прямой связи между размерами (общей массой) наземных животных
и удельной массой скелета и отсутствием такой зависимости у животных,
обитающих в водной среде. Более того, удельная масса скелета отдельных
видов наземных млекопитающих, "возвратившихся" в процессе эволюции
в водную среду, снижается более чем в 3 раза (см. Оганов, 2003).
Впервые эта закономерность была сформулирована еще Галилео Галилеем как
принцип подобия, суть которого заключается в том, что масса (прочность)
скелета наземных животных является функцией от нагрузки и связана с массой
и размерами их тела. Развитие и интерпретация принципа подобия в наше
время убедительно показали, что эволюция наземных позвоночных является,
по существу, прогрессирующим развитием приспособлений, направленных на
противостояние силе тяжести [Смит, 1975; Carter et al., 1991].
Формообразующая роль силы тяжести, по-видимому, реализовалась на всем
протяжении эволюционного процесса. Так, в филогенезе у земноводных внутренний
костный скелет, структурно и функционально объединенный с мышечной системой
в единый опорно-двигательный аппарат, впервые оказывается организован
на четырехопорной основе. Как показано, общая форма тела и тип симметрии
животных являются производными от способа и характера их перемещений,
что, в свою очередь, также определяется силой и направлением земного тяготения.
Развитие симметричных структур, в частности скелетно-мышечных, только
тогда и начинается, когда тело животных приобретает значительный вес [Зенкевич,
1944]. Это согласуется с точкой зрения A.Carter et al. (1991), которые
полагают, что механическая регуляция организации костной ткани, ее дифференциации,
метаболической активности и роста начинается на ранних этапах ее развития.
При этом, как полагают авторы, механика развития, или эволюционная механика,
играет главную роль в развитии не только костно-мышечной системы, но и
других тканей и органов.
Весовая нагрузка, надо полагать, не единственный фактор, стимулирующий
и канализирующий прогрессивную эволюцию ОДА. Другой составляющей "внешнего
механического поля" служила динамическая стимуляция костей, характер
которой менялся по мере совершенствования мышечных функций ОДА у наземных
животных.
Согласно принципу "кинетического совершенства" [Шноль, 1979]
прогрессивная эволюция биологической подвижности определялась соответствием
тех или иных форм движений определенным механическим (кинетическим) критериям
(скорости, маневренности), что, в конечном счете, и привело к появлению
современных форм движения с помощью специализированных двигательных (мышечных)
волокон.
Действительно, в процессе дальнейшего развития позвоночных на суше периферический
механизм мышечного тонуса (ацетилхолиновая контрактура) в силу своей консервативности
начинает все менее соответствовать повышенным двигательным задачам, которые
сопряжены с необходимостью не только поддерживать тело на поверхности,
но и обеспечивать маневренность, быструю смену поз и фиксацию положения
тела животного перед началом движения [Шноль, 1979].
Появление жесткого скелета и конечностей, которые строго ограничивают
рабочую длину мышц, привело к дальнейшему совершенствованию организации
способа сокращения мышц и всей мышечной системы - смене тонической мускулатуры,
напряжение которой не зависит от начальной длины, на поперечно-полосатую
с фазным типом сокращения, т.е. уже обладающую механизмом распространяющегося
потенциала действия и высокой скоростью сокращения [Наследов, 1981].
Таким образом, в мышечной составляющей "внешнего механического поля",
способствующей прогрессивной эволюции скелета, следует, по-видимому, различать
две компоненты: постоянную (статическую), связанную с участием мышц в
регуляции позы в поле земного тяготения, и переменную (динамическую),
обеспечивающую локомоторную активность и перемещение в пространстве [Оганов,
1988]. Не вызывает сомнений то, что первая так или иначе обусловлена наличием
гравитации, противостоит ей и опосредует ее вторичное (помимо весового)
механическое воздействие на скелет [Гурфинкель и др., 1965].
Можно предположить, что вторая составляющая как источник постоянно меняющихся
нагрузок могла стимулировать также становление и развитие системы ремоделирования
костной ткани в филогенезе, которая, как известно, лежит в основе функциональной
адаптации костной ткани. Во всяком случае, анализ литературы выявил обстоятельство,
которое вряд ли можно считать случайным, а именно то, что механизм перестройки
(самообновления) кости начинает активно функционировать уже у бесхвостых
амфибий [Румянцев, 1958] и у них же впервые в составе тонической мускулатуры
начинают формироваться волокна фазного типа, обеспечивающие благодаря
своим характеристикам гораздо более быстрые перемещения и смену типа двигательной
активности [Наследов, 1981].
Важно, что и организмы, находящиеся в процессе развития, и взрослые человек
и животные весьма чувствительны к механической стимуляции, которая способна
влиять на адаптивное ремоделирование костной ткани и мышечные функции
в онтогенезе сообразно функциональным требованиям. Еще в XIX - начале
ХХ века многие естествоиспытатели-эволюционисты (Lamarck, 1809; Дарвин,
1872; Wolff, 1892; Roux, 1905) отмечали, что животные обладают способностью
адаптировать костно-мышечные структуры к физической активности, в которую
они вовлечены, и внешняя форма, а также внутренняя архитектура кости и
состав мышечных волокон постоянно модифицируются механическими стимулами,
которым подвергается скелетно-мышечная система. Морфологические и физиологические
модификации тканей и органов у взрослых животных, возникающие под влиянием
функциональных "требований" при взаимодействии организма с внешней
средой, принято называть "функциональной адаптацией" [Roux,
1905].
Таким образом, анализ литературы позволяет утверждать, что структурно-функциональное
единство костно-мышечной системы в процессе ее эволюции есть результат
конвергенции нескольких факторов: силы земного притяжения, обусловившей
соответствие массы скелета размерам тела наземных позвоночных; физико-химических
факторов, определивших современную организацию мышечного аппарата; совокупности
статических и динамических нагрузок, которые направляли совершенствование
конструкции локомоторного аппарата и специфическое распределение функциональных
напряжений в костях конечностей ради стабилизации их биомеханических характеристик
в безопасной зоне.
Отсюда был сформулирован ряд гипотез относительно возможных изменений
в костно-мышечной системы при дефиците или изменении характера механических
требований в условиях невесомости (Оганов, 2003):
1) исходя из принципа подобия Г.Галилея и данных сравнительно-физиологических
исследований можно было ожидать уменьшения костной массы;
2) изменение нормального распределения функциональных (динамических) напряжений
в кости может создавать новую топографию зон с высоким и низким уровнями
адаптивного ремоделирования;
3) упомянутые изменения могут привести к локальной перестройке исходной
структуры и изменению топографии механической анизотропии костной ткани;
4) изменение характера механических требований может привести к перестройке
сократительных свойств и функционально-морфологического профиля мышц,
сложившихся в процессе постнатального онтогенеза в поле земного тяготения.
2. Гравитационная физиология скелетных мышц. Функциональная пластичность
Уже в конце 60-х - начале 70-х годов на основе анализа результатов модельных
экспериментов (гипокинезия, постельный режим) и аналогичных литературных
данных стало понятно, что в увеличивающихся по длительности космических
полетах в скелетно-мышечной системе человека будут развиваться изменения,
которые позже были определены как "функциональная атрофия".
Об этом же свидетельствовали некоторые проявления дискоординации движений
после кратковременных полетов.
Для правильного понимания механизмов подобных эффектов у человека их изучение
желательно было бы по возможности "идеализировать", освободить
от вмешательств, продиктованных заботой о здоровье человека в полете (система
профилактических мероприятий - СПМ), и тем самым приблизить к ситуации
лабораторных опытов с животными, имеющими существенно большие аналитические
возможности.
Так родилась идея (Б.Егоров, А.Киселев), активно поддержанная академиком
О.Газенко, о создании автономных (беспилотных) специализированных биологических
спутников (СБС), с помощью которых предполагалось экспонировать в невесомости
животных и другие биологические объекты. Проработка вопроса (я был ведущим
физиологом Аванпроекта СБС) заняла достаточное время (1968-1973) и труд
моих коллег (Е.Ильин, Л.Серова, В.Магедов, В.Голов, В.Милявский и др.)
завершился полетом первого в данной серии биоспутника "Космос-605"
(1973).
Параллельно в лаборатории (конец 60-х - 70-е годы) разрабатывались и были
созданы ориентированные на биоспутники методы изучения сократительных
свойств скелетных мышц in situ и in vitro, а также нейромышечного взаимодействия
и биомеханики движений in vivo.
Для исследований in situ и in vitro были выбраны скелетные мышцы белых
лабораторных крыс, различные по своим анатомо-топографическим и биомеханическим
особенностям, а также по функциональному и метаболическому профилю составляющих
их волокон: камбаловидная (КМ) - преимущественно позная, длинный разгибатель
пальцев (ДРП) - сгибатель стопы, преимущественно локомоторная, плечевая
мышца (ПЛМ) - сгибательная и медиальная головка трехглавой мышцы плеча
(МГТМ) - разгибательная.
Односуставная КМ является активной антигравитационной мышцей, медленной
по сократительным свойствам и устойчивой к утомлению. В ее составе, судя
по активности сукцинатдегидрогеназы (СДГ), преобладают (80%) волокна промежуточного
типа [Stein, Padicula, 1962; Close, 1972]. По результатам морфометрических
исследований [Bruce, Nicol, 1981] в КМ соотношение медленных окислительных
волокон (МОВ) и быстрых гликолитико-окислительных (БГОВ) составляет 8,5:1,5
при отсутствии быстрых гликолитических волокон (БГВ). В отличие от этого
в типичной быстрой, легко утомляемой, двусуставной мышце ДРП соотношение
МОВ : БГОВ : БГВ составляет 0,3:3,6:6,1.
Как показали наши исследования и расчеты, названные мышцы по признаку
уменьшения скорости сокращения в норме образуют ряд: ПЛМ-ДРП-МГТМ-КМ.
При этом различия в паре ДРП- МГТМ статистически недостоверны, но в силу
своих топографических особенностей МГТМ более активна в антигравитационной
деятельности, в том числе по сравнению с другими головками трехглавой
мышцы плеча [Катинас, Потапов, 1971)].
По признаку величин потери массы после космических полетов изученные мышцы
образовали такой же ряд. Наибольшая потеря массы отмечена в КМ (56%),
наименьшая - в ДРП и ПЛМ (10 и 16% - различия недостоверны). Статистически
достоверно уменьшалась относительная (к массе тела) масса КМ и МГТМ.
На изолированных мышцах in situ (КМ и ДРП) [Oganov, Potapov, 1976] и на
препаратах глицеринизированных (скинированных) мышечных волокон всех названных
мышц, сокращающихся in vitro в растворе АТФ+Са, было установлено, что,
как и следовало ожидать, их реакции в условиях невесомости весьма различны.
Они наиболее выражены в медленной антигравитационной КМ: уменьшение массы
и размеров волокон, снижение силы и эластичности, достоверное увеличение
скорости сокращения. Аналогичные, но не всегда достоверные изменения отмечены
в антигравитационной МГТМ.
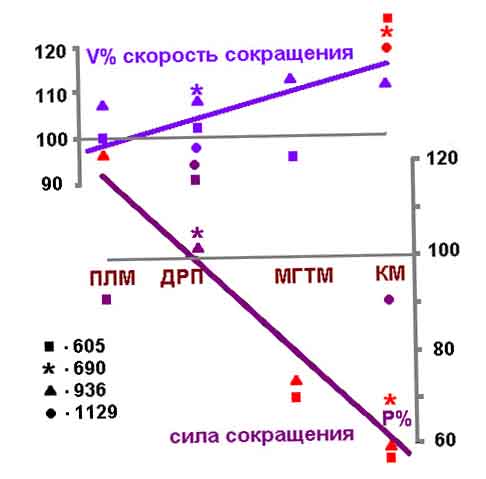
Рис.1. Влияние невесомости на сократительные свойства скелетных
мышц различного функционального профиля.
Как показано на рис. 1, представляющем результаты экспериментов
на четырех биоспутниках, наибольшее и достоверное увеличение скорости
сокращения отмечено в КМ как in situ, т. е. на изолированной мышце, возбуждаемой
электрическим раздражением, так и in vitro - на глицеринизированных волокнах.
Скорость сокращения другой разгибательной мышцы - МГТМ, также увеличивалась,
но не во всех опытах.
Одновременно показано, что обе разгибательные мышцы (КМ и МГТМ) существенно
и достоверно теряют способность генерировать силу (рис.1) и устойчивость
к утомлению.
Как и следовало ожидать, наибольшие изменения обнаружены в КМ и несколько
менее выраженные, но аналогичной направленности, в МГТМ. Из сопоставления
изменений функциональных характеристик мышц в полетной и контрольной группах
животных следует, что в позных мышцах. (КМ, МГТМ) они обусловлены непосредственным
действием невесомости. В отличие от этого временные характеристики быстрых
мышц ДРП и ПЛМ у полетных животных были сходны с их реакцией в условиях
синхронного контрольного эксперимента, а по силовым характеристикам в
полетной ПЛМ были отмечены признаки гиперфункции. Анализ результатов заставляет
думать, что они обусловлены, по всей вероятности, действием совокупности
факторов космического полета и условием содержания животных. В частности,
проявления гиперфункции в ПЛМ можно объяснить поведенческой адаптацией
животных в условиях безопорного пространства [Оганов, Потапов, 1979; Оганов,
1980]. Предполагается, что стремление стабилизировать положение тела в
этих условиях осуществляется за счет повышения активности (в том числе
тонического типа) главным образом передних конечностей, которые у крыс
лучше приспособлены к высокодифференцированным движениям. Это обстоятельство
ассоциируется со статистически достоверным увеличением суммарной двигательной
активности животных в полете, которое было отмечено нами в экспериментах
на биоспутниках [Климовицкий и др., 1979].
Описанные изменения морфофункциональных характеристик мышц, наиболее выраженные
в КМ (уменьшение массы мышц и размеров волокон, снижение силовых возможностей
и увеличение скорости сокращения, потеря эластичности), хорошо согласуются
с результатами других морфологических и биохимических исследований, выполненных
на аналогичном материале в экспериментах на биоспутниках. Они свидетельствуют
о выраженном развитии атрофии [Ильина-Какуева и др., 1977, 1979] и активации
процессов белкового распада [Гаевская и др., 1976, 1979а; Казарян и др.,
1977] преимущественно в КМ. В ДРП и других быстрых и смешанных мышцах
задней конечности, в том числе в скинированных волокнах, подобных явлений
не наблюдалось [Гаевская и др., 1978].
В параллельных биохимических исследованиях в экспериментах на биоспутниках
впервые были получены данные о перестройках состава миофибриллярных изопротеинов,
в частности, спектра изоферментов миозина и субъединичного состава тропонин-тропомиозинового
комплекса, по своей направленности соответствующих изменениям скоростных
свойств изученных мышц у тех же животных [Takacs et al., 1980, 1983; Оганов
и др., 1982]. Особого внимания заслуживает заметное увеличение в КМ миозинов
с легкой цепью ЛЦ-3 (Рис.2).
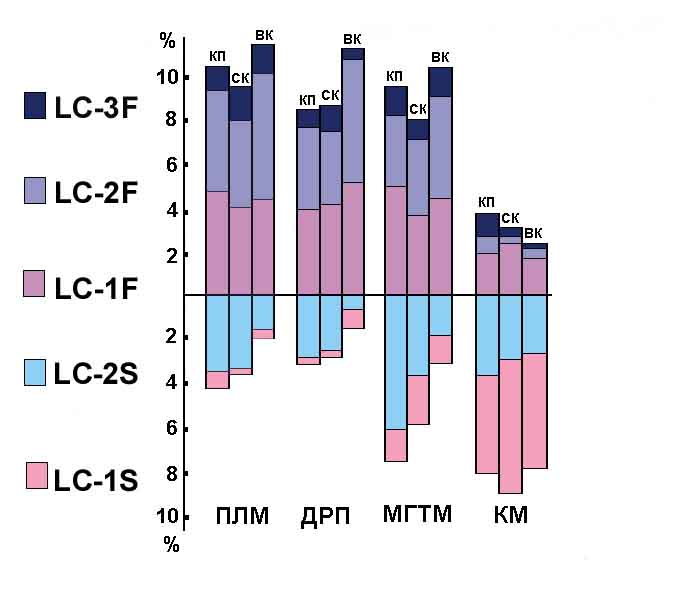
Рис.2. Влияние невесомости на изоферментный состав миозинов скелетных
мышц различного функционального профиля.
В норме КМ содержит лишь следы данной изоформы миозина. Как известно,
ЛЦ-3 входит в структуру молекулы лишь двух изоформ "быстрого"
миозина, и с ней ассоциируется высокая АТФазная активность быстрых мышечных
волокон [Weeds, Taylor, 1975; Taylor et al., 1977]. Одновременно в быстрых
мышцах (ПЛМ, ДРП, МГТМ) отмечена перестройка состава популяций миозинов
с увеличением изоформ "медленных" миозинов, хотя только в ПЛМ
это сопровождалось отчетливым снижением скорости сокращения мышечных волокон
[Оганов и др., 1982] и снижением чувствительности к Са в быстрой икроножной
мышце [Holy et al., 1985] (Рис.3). 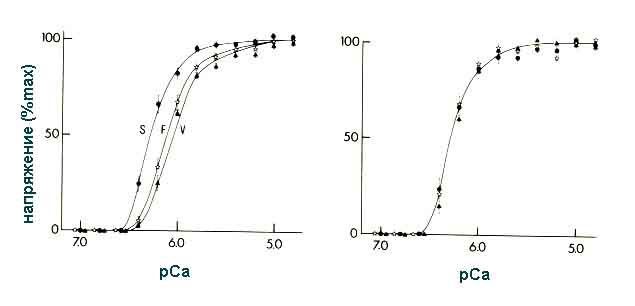
Рис.3. Снижение Са-чувствительности скинированных мышечных волокон
(икроножная, подошвенная мышцы) при АТФ-индуцированном сокращении in vitro.
Гистохимически у полетных животных обнаружено резкое снижение активности
окислительных ферментов (СДГ) в красных (медленных) волокнах КМ до уровня
их активности в промежуточных [Ильина-Какуева и др., 1979]. В этой же
мышце закономерно наблюдали перестройку спектра изоферментов лактатдегидрогеназы
[Петрова, 1978; Гаевская и др., 19796], свидетельствующую о торможении
процессов аэробного дыхания и активации гликолитического пути метаболизма
[Португалов, 1978].
Анализ результатов исследований, выполненных по материалам биоспутников,
показывает, что реакции скелетных мышц крыс на действие невесомости или
совокупности факторов космического полета имеют системный характер. Однако
при этом выраженность и направленность изменений в различных мышцах зависят
от степени их участия в позной деятельности (у данного вида животных),
анатомо-топографических и биомеханических особенностей мышц, а также характера
изменений биомеханических требований к отдельным мышцам по сравнению с
паттерном их сократительной активности на Земле.
Позднее эти результаты были подтверждены и во многом совпадали с данными,
описанными в работах Templeton et al. (1984), Baldwin (1996) и в совместной
работе с исследователями США [Tomason et al., 1996].
Следующей задачей исследовании было установить, с какими изменениями "внешнего
входа" на мышцы могут быть связаны те из описанных выше изменений
их физиологических свойств, которые мы имеем основание считать обусловленными
непосредственным действием невесомости.
Экспериментально эту задачу - определить значение различных компонентов
движения для поддерживания мышц в нормальном (дифференцированном) состоянии
- решали методом исключения в одном случае преимущественно фазического
компонента движений и уменьшения их общего количества (гипокинезия), а
в другом -тонического компонента и силовой (опорной) нагрузки на мышцы
(гиподинамия). Необходимость дифференциации эффектов гипокинезии и гиподинамии
в скелетных мышцах диктуется и соображениями научно-практического характера,
поскольку в условиях космического полета и то, и другое имеет место, как
заданные физические характеристики среды существования.
Ситуацию гипокинезии создавали содержанием животных в тесных клетках-пеналах,
размер которых мог изменяться таким образом, что соотношение объемов тела
животного и клетки сохранялось постоянным [Оганов, Потапов, 1973]. Условия
гиподинамии для мышц плеча создавали с помощью ампутации дистальной части
предплечья [Катинас, Потапов, 1971]; для мышц задней конечности - лишением
их опоры в модели "вывешивания" [Ильин, Новиков, 1980].
Кроме того, для контраста изучали модель активации позных мышц при длительном
действии ускорений, которые создавались вращением животных в центрифуге
в течение 22 суток [Oganov et al., 1980].
Таким образом, мы могли сопоставить реакции исследуемых мышц в континууме
гравитационной нагрузки от 0g до 2g. Из рис.4 можно видеть, что скорость
сокращения разгибательных мышц (на рисунке она представлена обратной величиной
- временем развития сокращения до максимума) имеет близкую к линейной
связь с величиной гравитационной нагрузки.
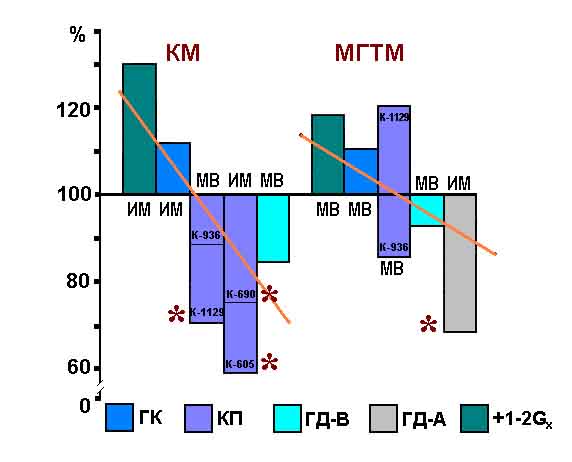
Рис.4. Время развития сокращения скелетных мышц в "континууме"
значений гравитационного поля.
Отсюда возникли основания полагать, что главной причиной приспособительных
изменений в позных мышцах крыс в космическом полете являются их силовая
разгрузка и дефицит тонического компонента движений, обусловленные невесомостью.
Реакция быстрых мышц в этих же условиях опосредована поведенческой адаптацией
и может быть обусловлена вовлечением их в несвойственную тоническую деятельность.
Новые функциональные признаки мышц приспособительного характера, появляющиеся
при долговременном изменении биомеханической ситуации и адекватные ей,
могут не соответствовать задачам организации движений при восстановлении
прежних условий двигательной деятельности.
Для того, чтобы экспериментально проверить это предположение, изучали
различные проявления мышечной активности у животных (собаки) непосредственно
в процессе движений после моделирования аналогичных условий относительного
неупотребления двигательного аппарата. С этой целью были разработаны оригинальные
устройство (имплантируемый тензоэлектрический датчик измерения натяжения
сухожилия) и метод для прижизненной регистрации механограммы сокращения
отдельных мышц (динамомиограммы) у собак в процессе локомоций [Гурфинкель,
Оганов, 1972; Оганов и др., 1975; Базжин и др.1975] (Авторское свидетельство
№ 456611), а также комплексный метод изучения биомеханических и кинематических
характеристик движения [Арзамасцев и др., 1982].
Гипокинезию у собак создавали с помощью системы фиксации, которая, исключая
возможность перемещения в пространстве, сохраняла таковую для выбора одного
из 3 положений животного ("стоя", "сидя", "лежа")
и позволяла регистрировать спонтанную двигательную активность (ДА) животных.
Модель гиподинамии создавали гипсованием одной из задних конечностей в
положении коленного сустава под углом 150°, а голеностопного - в положении
подошвенного сгибания.
Динамические характеристики мышечного сокращения и движений исследовали
в процессе выполнения животными функциональных проб - локомоций по третбану
с различной скоростью (0.56 м/с - ходьба, 1.39 м/с - бег) и ходьбы с дополнительным
грузом (12.5 и 37.5 % от массы тела животного). С помощью имплантированных
стальных электродов регистрировали биоэлектрическую активность (ЭМГ) мышц
задней конечности (икроножной - ИМ, передней большеберцовой - ПБМ, подошвенной
- ПМ, двуглавой бедра - ДМБ и четырехглавой бедра - ЧМБ), динамомиограмму
- имплантированными на неповрежденные сухожилия ИМ и ПМ тензоэлектрическими
преобразователями, подограмму - контактными датчиками; гониограммы коленного
и голеностопного суставов - навесной конструкцией потенциометрических
датчиков. Помимо этого, непосредственно при содержании животных в системе
фиксации у 6 из них регистрировали нейрограммы задних корешков спинного
мозга имплантированными электродами [Скуратова, Оганов, 1978].
На основе регистрируемых переменных рассчитывали параметры мышечного сокращения
в одном локомоторном цикле: интегральную энергию ЭМГ (ИЭМГ), мощность
биоэлектрической активации мышц (ИЭМГ в единицу времени), максимальное
и эффективное усилие, импульс силы, количество работы мышц, ее "биоэлектрическую
стоимость" (ИЭМГ : ИМПУЛЬС силы) и обратную ей величину - элементарную
эффективность (ЭМЭМ). Рассчитывали также кинематические и биомеханические
параметры, характеризующие временную и пространственную структуру движений.
После 20-40 дней гипокинезии установлено значительное увеличение (в 1.5-2
раза) средней мощности ЭМГ при ходьбе и беге в мышцах, активных в опорном
периоде шага (ИМ, ПМ, ДМБ и ЧМБ), и некоторое снижение этого параметра
в ПБМ (Рис.5). Отмечено также уменьшение максимального усилия икроножной
мышцы, наиболее заметное при беге и. статистически значимое после 40 и
60 дней гипокинезии. Одновременно с этим наблюдалось снижение скорости
развития усилия без изменения средней мощности и увеличение общего времени
механической активности мышцы и выполняемой работы. Такой характер изменений
электрофизиологических и механических параметров сокращения икроножной
мышцы приводит к значительному возрастанию "биоэлектрической стоимости"
работы ИМ в опорном периоде шага (в 1.5-2 раза при ходьбе и 2-3 раза при
беге), т.е. к снижению электромеханической эффективности (ЭМЭМ) ряда мышц.
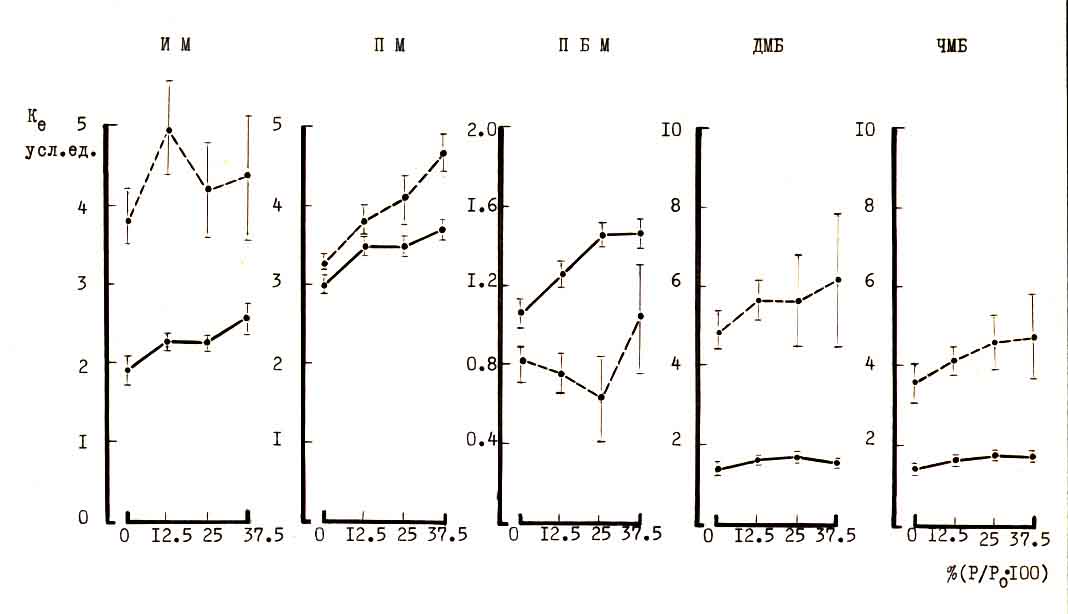
Рис.5. Зависимость коэффициента интенсивности возбуждения (ИЭМГ/сек)
мышц задней конечности собаки от величины дополнительной нагрузки при
ходьбе со скоростью 0,56 м/сек в норме и после 40 дней гипокинезии (пунктир).
Таким образом, результаты исследований иллюстрируют, что, независимо от
биомеханических особенностей рассмотренных моделей инактивации мышц у
собак, они приводят к определенной перестройке физиологических характеристик
мышц, имеющей признаки функциональной недостаточности. Это сопровождается
дезорганизацией движений, что проявляется неустойчивостью походки, возрастанием
темпа локомоций, удлинением периода опоры, увеличением амплитуды и скорости
вертикальных перемещений в дистальных суставах задней конечности [Рахманов,
1978].
Исходя из этих данных и основываясь на положениях "кинезологической
электромиографии" был разработан метод - функциональная проба - "Миотест",
которая позволяет проводить прижизненную количественную оценку состояния
скелетных мышц у человека по предложенному критерию электромеханической
эффективности (ЭМЭМ) [Гурфинкель и др., 1979]. (Авторское свидетельство
№ 665893)
Исходной посылкой служило представление о мышце как о "электромеханической
системе", генерирующей силу в ответ на биоэлектрическую активацию
[Bouisset, 1973]. Таким образом, указанный критерий отражает передаточную
функцию мышцы и рассчитывается как отношение импульса силы (ИС) этих мышц
(выходной параметр) к четырехинтегральной ЭМГ (ИЭМГ) (входной параметр)
в активной фазе стандартного движения с заданным усилием не более 10%
от произвольного максимального. Схема установки для реализации метода
и регистрируемые параметры показаны на рис.6.
Для тестирования состояния мышц голени в условиях АН0Г использовали специально
сконструированный актограф с подвижной педалью, смонтированной на платформе
(рис.6А). Более подробное описание устройства дано в работе Оганов с соавт.
(1991).
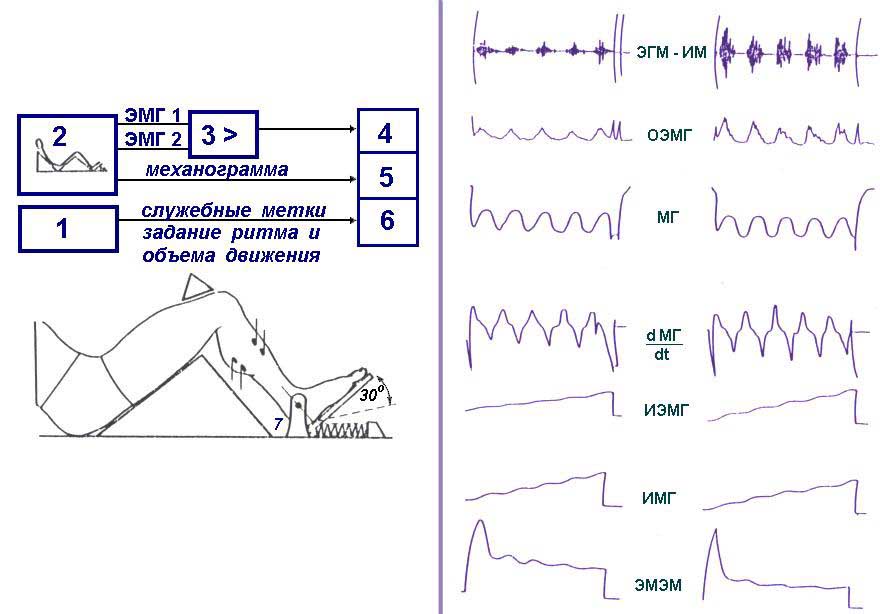
Рис.6. Схема тестирования функции мышц по критерию электромеханической
эффективности - "Миотест" и алгоритм расчета ЭМЭМ.
При проведении тестов регистрировали с помощью накладных электродов интерференционную
ЭМГ мышц: латеральной икроножной (ЛИМ), передней большеберцовой (ПБМ).
Одновременно с ЭМГ на магнитном носителе регистрировали еще ряд параметров,
которые показаны на рис.6Б. В итоге отношение импульса силы к ИЭМГ в активной
фазе движения и являлось мерой для количественной оценки величины ЭМЭМ.
В исследованиях с участием 18-ти добровольцев в условиях 182-cyточной
гипокинезии (постельный режим) и 4-х добровольцев в условиях 3-х дневной
водной иммерсии, а также при обследовании космонавтов после 140- и 175
суточных орбитальных полетов показано снижение ЭМЭМ, коррелирующее со
снижением максимальной мышечной силы (Рмакс). Установлено также, что физические
упражнения (ФУ) определенной интенсивности полностью предотвращают изменения
силы и электромеханической эффективности мышц, вполовину меньший объем
ФУ предупреждает снижение Рмакс, но не ЭМЭМ. Предполагается, что критерий
ЭМЭМ как интегральный показатель отражает изменения основных физиологических
характеристик мышц, в частности позных, при их относительной бездеятельности
в условиях постельного режима [Оганов и соавт., 1991].
Итак, полученные результаты свидетельствовали о высокой изменчивости или
динамичности сократительных свойств скелетных мышц в условиях невесомости
так же, впрочем, как и в других ситуациях, когда функциональные требования
к мышцам ("внешний вход") существенно изменяются вследствие
смены типа и количества движений и характера сокращений.
Рассмотрим, каковы реальные основы этой изменчивости и что можно сказать
о ее природе.
Сравнительно недавно были описаны результаты, которые, в противоположность
мнению об относительно жестком эндогенном программировании предположительно
различных фенотипов мышечных волокон, позволили сформулировать положение
о динамическом характере дифференциации мышц и полиморфизме мышечных фенотипов.
Оно основано на способности мышечных волокон различных типов изменять
сократительные свойства в соответствии с функциональными требованиями
[Катинас и др., 1981; Guba, 1981, Egerton, 1985; Валиулин, 1996; Baldwin,
1996].
Дальнейшее развитие этой идеи привело к формированию точки зрения, получающей
все большее распространение, согласно которой различные типы мышечных
волокон не представляют в действительности разные клеточные типы, но являются
лишь крайними проявлениями экспрессии единого фенотипа [Улумбеков, Резвяков,
1980].
В основе изменчивости фенотипа мышечного волокна, как полагают, лежит
полиморфизм сократительных белков [Gauthier, Lowey, 1979; Syrovy, 1979]
и лабильность типа энергетического метаболизма мышечных волокон [Booth,
1982; Lebherz, 1984]. В конечном итоге функциональный тип мышечного волокна
и мышцы в целом определяется экспрессией конкретного миозина, которая
задается и собственной программой миогенных клеток, и экзогенными факторами
[Пинаев, 1981; Улумбеков, 1981; Van Raamsdon et al., 1982]. Влияние последних
опосредуется центральной нервной системой и реализуется комплексом факторов,
объединяемых понятием гомеостатического контроля [Оганов, 1988], включающего
нейротрофические, нейроэндокринные и гуморальные влияния и локальные или
автономные регуляции [Egerton et al., 1985]. В качестве одного из таких
путей наиболее реален перенос к мышце с аксонным током специфических химических
веществ, синтезируемых в перикарионе мотонейронов [Albuquerque et al.,
1974; McArdle, 1983; Davis et al., 1985, Валиулин, 1996].
Выше было показано, что сократительные свойства скелетных мышц различного
функционального назначения трансформируются в экспериментальных условиях,
в том числе в космическом полете, в строгом соответствии с изменениями
внешних механических требований к каждой из них.
Таким образом, эффект нейротрофического (или в широком смысле - гомеостатического)
контроля может реализовываться в скелетных мышцах перепрограммированием
синтеза сократительных и саркоплазматических белков [Samaha et al., 1970;
Разумовская, 1980; Baldwin, 1996]. Постоянная их деградация и обновление,
по всей вероятности, создают в мышце некое неустойчивое равновесие белкового
состава [Booth, 1982], динамический характер которого позволяет подстраивать
набор миозинов в каждой мышце к требованиям внешней среды, чтобы реализовать
сократительную функцию наиболее адекватно.
Понятно, что скорость действия системы нейротрофического контроля, как
и любых других факторов, адресующихся к генетическому аппарату протеосинтеза,
лимитирована скоростью обновления сократительных белков. Последняя весьма
различна в сердечной мышце и медленной и быстрой скелетных мышцах. В этом
ряду наиболее коротка длительность полупериода жизни миозина в сердечной
мышце (4-6 дней) несколько больше в медленной - до 2х недель, в быстрой
- до 1 месяца [Earl et al., 1978]. Скорость обновления различных саркоплазматических
белков также неодинакова в одном и том же мышечном волокне. Отсюда может
возникать гетерохронность колебаний метаболизма белков и ферментных комплексов
в мышцах, в частности в различных моделях инактивации двигательного аппарата
[Booth, 1982]. Такая ситуация может быть описана как некая совокупность
подсистем регулирования с различным быстродействием при том, что все они
принципиально медленные.
В быстродействующей (рефлекторной) системе управления движениями и позой
(оперативный контур регулирования), принципиально отличающейся от гомеостатического
контроля высокой скоростью проведения команд, также различают подсистемы
срочной ("оперативной") и медленной ("консервативной")
адаптации к невесомости (Clement et al., 1984). К первой относят способность
почти мгновенного перераспределения в невесомости активности позных мышц.
Вторая проявляется к концу 7-дневного космического полета перестройкой
позного регуляционного паттерна в виде потери упреждающей активности в
некоторых мышцах. Можно допустить, что в основе второго типа адаптации
центральной программы регуляции позы также лежат процессы нейротрофического
характера, которые реализуются как на нервно-мышечном, так и на межнейрональном
(внутрицентральном) уровнях.
Не исключено, таким образом, что взаимодействие оперативного и гомеостатического
контуров регулирования, например, в процессе адаптации к новым условиям
двигательной деятельности, осуществляется в некоем континууме регуляторных
подсистем (нервно-рефлекторных, нервно-гормональных, нервно-трофических),
которые различаются между собой по времени реализации эффектов в широком
диапазоне (от миллисекунд до дней и недель) и, возможно, перекрываются
по этому параметру.
Анализ результатов исследований и литературных данных позволяет сделать
следующие заключения.
Высокая чувствительность скелетных мышц современных наземных млекопитающих
к изменениям величины гравитационного поля обусловлена эволюционно. Их
реакция на невесомость носит системный характер, но ее проявления в разных
мышцах зависят от степени их участия в антигравитационной деятельности,
их функционального и метаболического профиля и характера изменений биомеханических
требований к каждой конкретной мышце.
Наибольшей чувствительностью к невесомости проявляют, как и следовало
ожидать, антигравитационные мышцы, в той или иной степени участвующие
в поддержании тела животных над поверхностью опоры. Судя по результатам
исследований, в космическом полете в них развиваются приспособительные
реакции двух типов: атрофия от бездеятельности и перестройка функционально-метаболического
профиля определенных волокон. О том, что оба типа приспособительных реакций
являются активными процессами и осуществляются с помощью нервной системы,
свидетельствуют и ранние работы А. Г. Гинецинского и сотр. (1945), и большая
современная литература.
Как показал сравнительный анализ результатов наших исследований в различных
моделях инактивации или гиперфункции мышц, в позных мышцах адаптивные
изменения в условиях невесомости вызваны непосредственно уменьшением силовой
нагрузки на мышцы и дефицитом тонического компонента движений [Оганов,
1988]. Функциональные проявления изменений в быстрых мышцах, по-видимому,
- следствие поведенческой адаптации животных к совокупности факторов космического
полета и адекватны новому виду их деятельности. Приспособительные изменения
позных и сгибательных мышц обратимы для полетов продолжительностью до
22 суток.
Описанные эффекты космического полета и модельных ситуаций в скелетных
мышцах опосредованы системой гомеостатического контроля состояния мышц
в широком ее понимании. Предполагается, что медленно действующий гомеостатический
контур регулирования структурно-функциональной организации мышц "подстраивает"
их функциональный профиль сообразно меняющимся требованиям внешнего "механического
поля". Возможности для этого заложены в динамической организации
белкового и энергетического метаболизма мышц. Гравитационно-зависимые
изменения, обнаруженные в скелетных мышцах, - частный случай проявления
их функциональной пластичности. Есть основания полагать, что адаптивные
изменения скелетной мускулатуры, развивающиеся в космическом полете (в
отсутствие профилактических мероприятий), могут стать в периоде реадаптации
одной из причин двигательных расстройств вследствие десинхронизации восстановительных
процессов в системах оперативного (нервного) управления движениями и гомеостатического
контроля структурно-функциональной организации мышц.
Резюме
Сократительные свойства скелетных мышц (CM) различного
профиля (преимущественно позные или локомотрные) преобразуются в невесомости
специфично и сообразно биомеханическим требованиям, по разному меняющимся
в этих условиях для каждого типа СМ. В "медленных" позных мышцах
увеличивается скорость сокращения, снижается сила и работоспособность
(трансформация в "быстрые") и это сопровождается адекватной
перестройкой состава изомиозинов, субъединиц ТН-ТМ-комплекса, изоформ
миофибриллярной АТФазы. характера энергетического обмена.
Характер перестройки сократительных свойств позных СМ в континууме гравитационного
поля (0g-1g-2g) определяется такими биомеханическими факторами, как величина
опорной нагрузки и присутствие тонического компонента движений. При этом
зависимость изменения скоростных свойств СМ и мышечных волокон в заданном
диапазоне гравитационной нагрузки имеет близкий к линейному характер.
Изменения физиологических свойств скелетных мышц (СМ) в невесомости -
частный случай функциональной пластичности или проявление смены экспрессии
единого полиморфного фенотипа мышечной клетки в заданных условиях "внешнего
механического поля". Характер таких изменений в невесомости зависит
от степени участия различных СМ в постуральной деятельности на Земле.
Процесс функциональной адаптации СМ к невесомости, как и переход к земному
паттерну сократительной активности - в том и другом случае могут стать
причиной дезорганизации движений в силу нарушения координации между различными
уровнями систем моторного контроля (оперативный, гомеостатический).
3. Гравитационная физиология костной системы
3.1. Баланс кальция и ранние исследования минеральной
плотности костной ткани у космонавтов
Основу костной ткани человека и животных составляют органические вещества,
которые представлены фибриллами белка коллагена, синтезируемого остеобластами,
неколлагеновыми белками или белково-углеводными комплексами (протеогликанами),
выполняющими функции пространственной консолидации коллагеновой матрицы,
а также минорными белками, осуществляющими помимо структурной функции
роль регуляторов костеобразования (остеокальцином, фибронектином, остеопонтином
и др.). Жесткость органическому матриксу кости придает минеральный компонент,
который в скелете позвоночных представлен в основном гидроксиапатитом
и в виде нанокристаллов встроен в фибриллы коллагена и в межфибриллярные
пространства межуточного вещества кости. Костная ткань содержит 98 % всех
минеральных веществ организма (Са, Р, Mg, Na), из которых 99 % приходится
на долю кальция [Canalis, 1990].
В связи с этим в диагностике состояния костной ткани в начальный период
систематических полетов в космос (конец 1960-х - начало 1970-х годов)
в качестве основных показателей изменения состояния костной ткани использовались
показатели баланса кальция и его кинетики в организме. Не останавливаясь
на этих результатах (подробнее см. Оганов,2003), укажем лишь, что по данным
биохимического анализа биопроб, полученных в полетах орбитальной станции
(ОС) "Скайлэб" (1973г), ежемесячные потери кальция достигали
0,3-0,4 % от его общего количества в организме [Rambaut, Johnson, 1979].
Несоответствие между потерей общей массы минералов тела и небольшим (в
среднем) снижением минеральной плотности пяточной кости [Rambaut, Johnson,
1079; Ступаков, Воложин, 1989], само по себе вовсе не неожиданное, стимулировало
поиск иных источников потерь кальция. Гипотетически это могли бы быть
позвоночник и бедренная кость, где суммарная масса метаболически высокоактивной
трабекулярной кости составляет около 70 % от таковой во всем скелете [Человек.
Медико-биологические данные. 1977].
В 1982-1987 гг. нами была проведена первая серия обследований космонавтов
ОС "Салют-7" с использованием компьютерного томографа GECT-7800
("Дженерал электрик", США) с оригинальными методикой и программой
анализа данных [Cann, Gernant, 1980]. Благодаря этому удалось впервые
количественно оценить изменения минеральной плотности поясничных позвонков
и избирательно - губчатой костной ткани тел позвонков у космонавтов после
полетов продолжительностью от 150 до 237 сут. При этом в ряде случаев
выборочно измеряли минеральную плотность костной ткани (МПКТ) передних
(тело, концевая пластинка) и задних (поперечные и остистые отростки) элементов
позвонков, а также плотность мышц спины (подвздошно-реберной, выпрямителя
спины и межостистой). Впервые было показано не вполне ожидаемое увеличение
минеральной плотности (г/см3) губчатой структуры центральной части поясничных
позвонков у 5 из 7 космонавтов (в 2х случаях - достоверное) [Оганов и
др., 1990].
3.2. Современная остеоденситометрия. Методы исследований, объекты и
критерии оценки состояния костной ткани
Методы. На протяжении функционирования ОС "Мир"
непрерывно совершенствовалась медицинская техника, применяемая для диагностики
состояния костной ткани. Упомянутые выше обследования космонавтов ОС "Салют-7"
выполняли на компьютерном томографе GECT-7800 ("Дженерал электрик",
США), используя программу, повышающую точность измерения оптической плотности
в единицах Хансфилда (количественная компьютерная томография - ККТ) [Cann,
Genant,1980]. Часть космонавтов ОС "Салют-7" и "Мир"
обследовали с помощью костного денситометра ДВ-6000 (Norland, США, двухфотонная
радионуклидная абсорбциометрия - ДФА). С начала 1990-х годов обследования
космонавтов ОС "Мир" (начиная с 6-й основной экспедиции) были
выполнены на двухэнергетическом рентгеновском денситометре QDR-1000/W
(Hologic, Waltham, МА, США), предоставленном специалистами НАСА.
Двухэнергетическая рентгеновская абсорбциометрия (dual energy x-ray absorbtiometry
- DEXA) основана на различной проникающей способности излучения разной
жесткости (энергии) и позволяет по величине поглощения оценить проекционную
минеральную плотность костной ткани - МПКТ, г/см2 (bone mineral density
- BMD, g/cm2) и содержание костного минерала - СКМ, г (bone mineral content
- BMC, g) в любой интересующей области. Наличие двух энергетических областей
в спектре излучения позволяет расчетным (программным) путем исключать
влияние мягких тканей, а также по специальной программе регионального
анализа (Whole Body - "Все тело") проводить раздельное вычисление
минеральной плотности крупных звеньев скелета (черепа, рук, грудных и
поясничных позвонков, ребер, таза, ног) и рассчитывать состав тела по
параметрам СКМ, массы жировой ткани (fat mass, или масса жира - МЖ, г)
и тощей массы (lean body mass, ТМ, г).
Исследование клинически наиболее значимых областей (поясничного отдела
позвоночника, проксимального отдела бедра и некоторых других регионов)
проводили с помощью специальной программы с более высокой разрешающей
способностью (субрегиональный или локальный анализ).
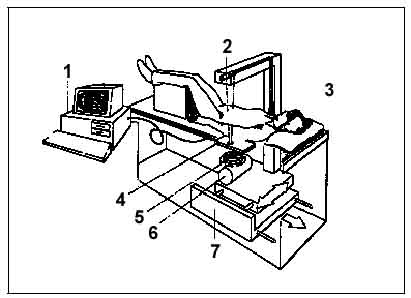
Рис.7. Схема денситометра: 1 - компьютер; 2 - детектор рентгеновского
излучения; 3 - подвижный стол; 4 - коллиматор; 5 - внутренняя калибровочная
система; 6 - рентгеновская трубка; 7 - механизм двухкоординатного сканирования.
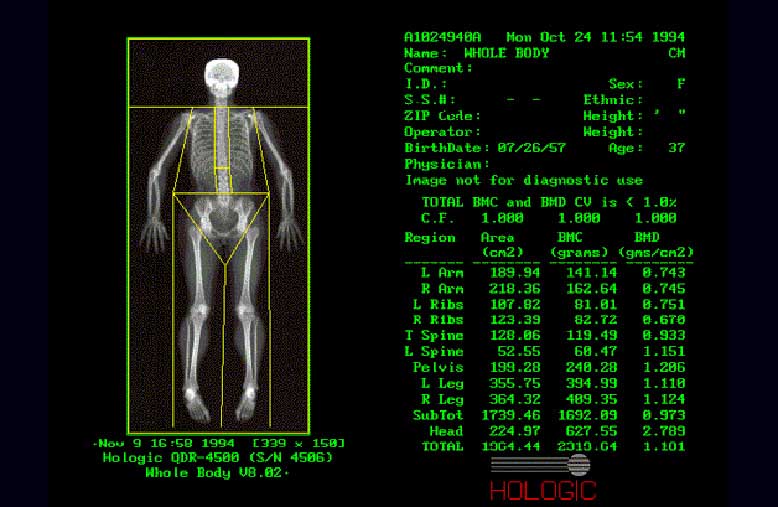
Рис.8. Сканирование "Все тело"
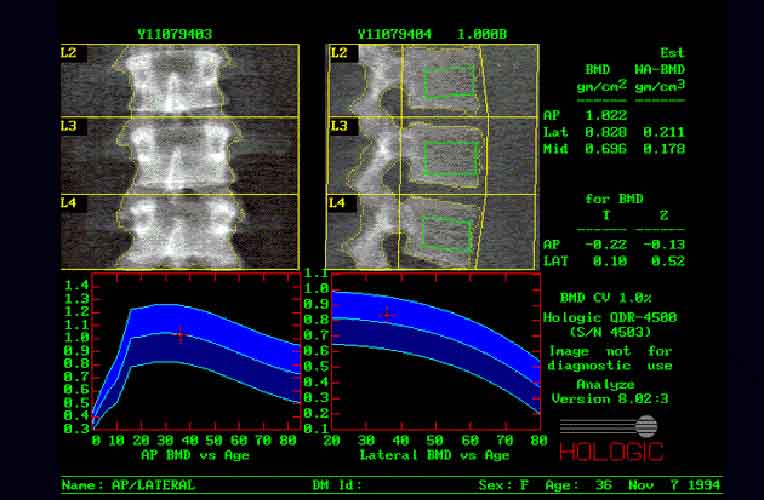
Рис.9. Сканирование поясничных позвонков
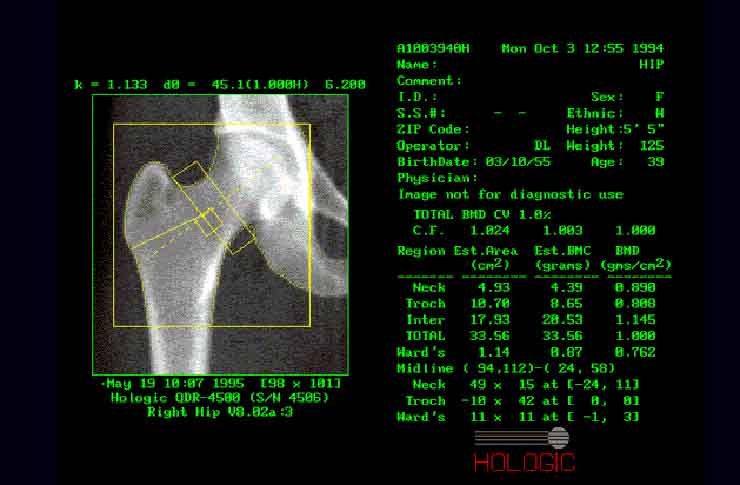
Рис.10. Сканирование бедренной кости
Обследуемый находился в положении лежа на спине. Продолжительность
стандартного исследования составляла 70 мин, суммарная лучевая нагрузка
- до 0,01 мЗв. Точность измерения составляла +0,5-1 % по локальным программам
(поясничные позвонки и проксимальный отдел бедра) и +1,5-2 % по программе
"Все тело".
Участники экспедиций на ОС "Мир" проходили обследование методом
DEXA за 30-45 сут до старта, на 3-и - 5-е сутки после приземления (обязательная
схема) и далее в период реадаптации, через 3-4 нед (в некоторых случаях),
3-6 мес. и 1 год (расширенная циклограмма). В необходимых случаях по показаниям
(восстановление МПКТ замедлено) обследования продолжали до 3 лет по индивидуальной
схеме.
Объекты исследований. Было обследовано 38 космонавтов в возрасте 33-53
лет (российских и зарубежных) - членов экипажей основных экспедиций (ЭО)
и экспедиций посещения (ЭП), на ОС "МИР", в том числе после
повторных или многократных полетов - 20 космонавтов. Длительность полетов
составляла в основном 5-7 мес., но обследования проводили и после полетов
меньшей (20-30 сут.) и большей (10-14,5 мес.) продолжительности. Некоторые
космонавты участвовали в нескольких экспедициях, поэтому практически проводился
многолетний мониторинг состояния их костной системы. Всего было выполнено
58 обследований, включавших по несколько сеансов обязательной или расширенной
циклограммы. Напомним, что каждый сеанс обследования содержал от 4 до
6 программ сканирования: региональный анализ по программе "Все тело",
локальный анализ поясничного отдела позвоночника, проксимального эпифиза
бедренной кости (билатерально) и иногда костей голени и пяточной кости.
В настоящее время продолжаются обследования российских космонавтов- членов
экипажей международной космической станции (МКС).
Критерии оценки состояния костной ткани. Для интерпретации результатов
DEXA проводили сравнение полученных данных с соответствующими значениями
"пиковой" возрастной и половой нормы, имеющимися в базе данных
денситометра Hologic.
Сравнение с нормой проводится обычно по двум показателям: 1) сравнение
с нормальной "пиковой" костной массой (Т-масштаб), т.е. с типичными
значениями для того возраста, в котором минеральная плотность в данном
участке скелета достигает максимума (для разных отделов скелета этот возраст
может быть различным в пределах 20-25 лет); 2) сравнение с возрастной
нормой (Z-масштаб), т.е. с типичными значениями для данного возраста.
Результаты представляются в процентах к соответствующей норме, которая
в этом случае принимается за 100 %, и в единицах стандартной девиации
(SD).
Согласно рекомендациям ВОЗ [Kanis, 1994] диагностика остеодефицитных состояний
проводится на основании Т-масштаба: в пределах нормы находятся значения,
отклоняющиеся менее чем на 1 SD; значения менее -1 SD, но более -2,5 SD
классифицируются как остеопения, значения менее -2,5 SD классифицируются
как остеопороз и значения менее -2,5 SD при наличии хотя бы одного перелома
позвонка или шейки бедра - как тяжелый остеопороз. В референтных кривых,
используемых в современных денситометрах, отклонение величиной 2 SD (Т-масштаб)
соответствует примерно 20 % пиковой костной массы.

Рис.11 (без подписи)
Квалификация состояний костной ткани (регламент ВОЗ)
3.3. Результаты исследований. Основные тенденции.
3.3.1. Вектор гравитации и феномен перераспределения минералов в скелете
Таким образом, в выборку вошли данные 42 наблюдений на
ОС "Мир", проведенные за 11 лет (1990-2000 гг.). В этот период
объем и программа обследований неоднократно менялись, в связи с чем по
разным показателям количество наблюдений (n) может быть различным.
Результаты исследований в целом подтверждают основные (и ожидаемые) тенденции
изменений состояния костной ткани после длительных космических полетов,
опубликованные ранее [Оганов, Шнайдер, 1997; Оганов и др., 1992; Григорьев
и др., 1998; Oganov et al., 2001, Оганов, 2003].
Основная выявленная при этом закономерность состоит в том, что выраженность
и даже направленность изменений BMD и СКМ в разных сегментах скелета существенно
зависит от их положения в векторе гравитации (Рис.12).
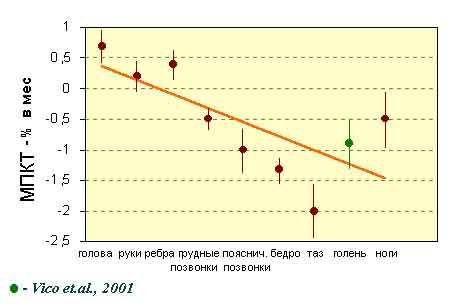
Рис.12. Скорость изменений МПКТ в сегментах скелета (по вектору гравитации).
Среднегрупповые значения изменений костной массы за время полета по всей
совокупности экспедиций на ОС "Мир" длительностью от 4 до 7
мес. суммированы в табл. 3.1.
Таблица 3.1
Среднегрупповые изменения костной массы у космонавтов ОС "Мир"
за время полета длительностью от 5 до 7 мес. (в процентах к предполетному
уровню), полученные при проведении регионального и локального анализов
|
Сегмент скелета
|
Показатель
|
n
|
M ± m
|
|
Кости черепа и шейного отдела позвоночника
|
МПКТ, г/см2
|
32
|
+2,21 +
0,57
|
|
СКМ, г
|
32
|
+4,76 +
0,84
|
|
Ребра
|
СКМ, г
|
32
|
+1,99 +
1,36
|
|
Кости рук
|
СКМ, г
|
32
|
+1,30 + 1,02
|
|
Грудные позвонки
|
МПКТ, г/см2
|
31
|
-0,98 +
0,64
|
|
СКМ, г
|
31
|
-3,14 + 2,57
|
|
Поясничные позвонки
|
МПКТ, г/см2
|
28
|
-5,89 +
0,71*
|
|
Кости таза
|
СКМ, г
|
30
|
-13,07 + 1,24**
|
|
Проксимальный эпифиз бедренной кости
|
Шейка
|
МПКТ, г/см2
|
31
|
-8,53 +
1,40**
|
|
Большой вертел
|
МПКТ, г/см2
|
31
|
-9,33 + 1,39**
|
|
Межвертельная
область
|
МПКТ, г/см2
|
31
|
-7,12 +
0,85*
|
|
Треугольник
Варда
|
МПКТ, г/см2
|
31
|
-10,08 +
1,48*
|
|
Суммарно по
эпифизу
|
МПКТ, г/см2
|
31
|
-8,00 + 0,99*
|
|
Кости ног
|
СКМ, г
|
32
|
-2,66 + 0,39
|
|
Скелет в целом
|
СКМ, г
|
32
|
от -1,5 до - 3,0
|
Как можно видеть из рис.12 и табл. 3.1, наибольшие отрицательные изменения
были обнаружены в костях таза, поясничных позвонках и проксимальном отделе
бедра, что может быть связано как с их биомеханической функцией (большая
весовая нагрузка при 1 g), так и с преимущественно спонгиозной структурой.
Потери в длинных трубчатых костях ног были существенно меньше, по всей
вероятности, в связи с тем, что в этом случае в зоне сканирования находится
относительно большая масса кортикальной кости, претерпевающая существенно
меньшие изменения по МПКТ в пределах данной длительности полетов.
В костях черепа и шейных позвонках, как правило, выявляется достоверное
повышение содержания костных минералов (СКМ), а в костях плечевого пояса,
рук и в ребрах - увеличение минеральной плотности, которое чаще всего
не превышало двойной ошибки метода, иными словами, было недостоверным.
Таким образом, наблюдается отчетливая тенденция, которая позволяет говорить
о феномене перераспределения минералов в скелете (табл. 3.2).
Таблица 3.2
Изменения минеральной плотности костной ткани (МПКТ, %) и содержания
минералов (СКМ, г) в различных сегментах скелета после космических полетов
продолжительностью 5-7 мес.
|
Показатели
|
Все тело
(СКМ)
|
Голова и шейные позвонки (СКМ)
|
Поясничные позвонки L1-L4 – суммарно
(МПКТ)
|
Кости таза
(СКМ)
|
Проксимальная бедренная кость
– суммарно (МПКТ)
|
|
M ± m, %
|
-1,36 ± 0,33
|
+4,76 ± 0,84
|
-5,89 ± 0,71
|
-13,07 ± 1,24
|
-8,00 ± 0,99
|
|
ДИК, %
|
от +2,70 до -6,25
|
от +12,4 до -3,0
|
от +1,57 до -15,93
|
от +6,43 до -22,78
|
от -0,10 до -22,68
|
|
СКМ, г
M ± m
|
-38,59 ± 9,11
|
+22,31 ± 3,44
|
-4,50 ± 0,66
|
-33,14 ± 3,28
|
-4,22 ± 0,68
|
|
n
|
31
|
32
|
28
|
30
|
31
|
Примечание. ДИК - диапазон индивидуальных колебаний.
Можно видеть, что изменения костной массы во всем скелете
у космонавтов-мужчин в полетах продолжительностью около 6 мес. (n = 19)
составляли -1,36 ± 0,33 %. Выявленные суммарные потери позволяют оценить
средний отрицательный баланс кальция за время полета, который составляет
около 100 мг/сут., или ежемесячные потери кальция, эквивалентные 0,25-0,3
% от его общего количества в организме человека. Результат получен косвенным
методом (перерасчет данных остеоденситометрии). Тем не менее, можно видеть,
что он незначительно отличается от данных биохимических исследований,
выполненных на материалах биопроб космонавтов после 3-х полетов на ОС
"Скайлэб".
Таким образом, общие потери минералов относительно невелики. Обнаруженные
в полете потери костной массы не представляли бы опасности, если бы распределение
изменений по сегментам скелета было более равномерным. Наибольшую опасность
представляет наличие критических, "быстро теряющих костную массу"
областей: костей таза, поясничных позвонков и шейки бедра. Именно из этих
зон минеральный компонент "перемещается" в костные структуры
верхних сегментов скелета.
Увеличение содержания минералов (СКМ) в костях верхних сегментов скелета,
по всей вероятности, можно считать одним из проявлений феномена перераспределения
жидкостных сред организма в краниальном направлении, который возникает
из-за неадекватного для условий невесомости функционирования антигравитационных
механизмов гемоциркуляции, сформированных в эволюции для условий 1g. Такие
же явления были описаны в экспериментах с АНОГ (-6°) длительностью 30
сут. (Arnaud, Morey-Holton, 1990), с постельным режимом длительностью
120 сут. [LeBlanc et al., 1990] и 20 сут. [Fukuoka et al., 1997; Nishimura
et al., 1994], а также в условиях 120-суточной АНОГ [Оганов и др., 1989,
1997б]. Что это может означать?
Одной из главных причин этого феномена могут быть гемодинамические факторы
[White, Blomqvist, 1998]. Показано, что у человека в вертикальном положении
на Земле существует гравитационный градиент капиллярного давления: от
25 мм рт. ст. на уровне головы до 90 мм рт. ст. на уровне стоп [Levick,
Michel, 1976]. Было выявлено, что в микрогравитации этот градиент может
снизиться до 30 мм рт. ст., и прямые измерения у добровольцев показали,
что в течение 8-часового пребывания в антиортостатическом положении (-6о)
капиллярное давление в сосудах головы возросло с 27,7 до 33,9 мм рт. ст.
[Hargens et al., 1992].
Существует достаточное число наблюдений, показывающих, что местное повышение
периферического венозного давления сопровождается активацией костного
ремоделирования [Kelly, Bronk, 1990] и способствует ускорению заживления
переломов [Kruse, Kelly, 1974]. Механизм этого явления остается неясным,
однако в нашем случае вряд ли имеет место формирование новой кости. Скорее
можно думать, что местное повышение гидростатического давления способствует
перемещению ионов и белков в костный интерстиций [McCarthy, Lang, 1992]
сохраняя, в частности, ионы кальция в аморфной фазе. В пользу такого предположения
косвенно свидетельствуют данные наших исследований в модельных условиях
(7-дневная иммерсия), когда тенденция к увеличению минерализации цефало-цервикальной
зоны скелета в этих условиях нивелировалась уже через 3 недели после окончания
эксперимента [Котов и соавт., 2003].
Эта гемоциркуляторная версия подтверждается в исследовании с участием
женщин (АНОГ, -60, 120 сут.) результатами изучения церебральной гемодинамики
у них, в частности, в группе Б (нетренирующиеся). С помощью ультразвуковой
допплерографии (УДГ) и реоэнцефалографии (РЭГ) выявлены признаки недостаточности
кровообращения головного мозга. В вертебробазиллярном бассейне и в целом
в системе магистральных артерий головы отмечено снижение линейной скорости
кровотока и пульсового кровенаполнения. При неврологическом осмотре эти
изменения проявляются заинтересованностью стволовых структур мозга. Физическая
тренировка (группа А) в этом же эксперименте способствует более медленному
развитию церебральных гемодинамических нарушений у женщин [Чумак, Клюева,
1999].
Наличие признаков вовлечения процессов регуляции Са2+ в общий комплекс
расстройств водно-электролитного баланса, связанных с перераспределением
жидкостных сред, приводит к предположению, что для гомеостаза и распределения
Са2+ в организме в условиях невесомости значительную роль могут играть
механизмы волюмо- и ионорегуляции [Григорьев, Ларина, 1992], в частности
в терминальном сосудистом русле [Arnaud et al., 1992].
3.3.2. Феномен гиперминерализации поясничных позвонков
Несколько неожиданным оказался феномен избирательного
увеличения минеральной плотности центральной губчатой костной ткани тел
поясничных позвонков (ПП), впервые обнаруженный методом ККТ после космических
полетов [Oganov et al., 1991; Оганов, Шнайдер, 1997] и в условиях гипокинезии
[Оганов и др., 1988; Arnaud, Morey-Holton, 1990]. Он ассоциируется с ранее
выявленными тем же методом аналогичными изменениями в ПП у больных, длительное
время находившихся на постельном режиме по поводу лечения сколиоза [Hansson
et al., 1990] или спинномозговой травмы [Woodard et al., 1988]. Учитывая
вероятность гиперминерализации в клинике, ее возможные причины требуют
более детального анализа. В связи с этим рассматривается несколько версий.
В качестве возможных причин данного феномена рассмотрены: вероятность
изменения внутридискового давления; изменение биомеханики паравертебральных
мышц и геометрии позвоночника; накопление старой высокоминерализованной
фракции минерального компонента вследствие общего замедления процессов
ремоделирования; накопление крови в брюшной полости, свидетельством чего
могут быть т.н. застойные паренхиматозные органы. Известны результаты
исследований, которые позволяют отдать предпочтение последнему фактору
[Оганов, 2003].
3.3.3. Квалификация
Клинико-физиологическая оценка обнаруженных изменений
учитывает упомянутый выше регламент ВОЗ, дифференцирующий остеодефицитные
состояния у человека по признаку МПКТ как норма - остеопения - остеопороз
[Kanis et al., 1994] с использованием стандартов Hologic.
Обращаясь к табл. 3.1, можно уточнить, что среднегрупповые значения потерь
за полет в сегментах поясничных позвонков (5,89 %) составляют в абсолютных
значениях 0,064 г/см2. Тогда как "стоимость" (величина) 1SD
для этой зоны у лиц молодого возраста (пик костной массы в 25 лет) равна
0,110 г/см2 (после уточнения по стандартам NHANES). Среднегрупповые значения
суммарных потерь за полет в проксимальном эпифизе бедра (8,0 %) и шейке
бедренной кости (8,53 %) составляют в абсолютных значениях 0,085 и 0,080
г/см2 соответственно. Абсолютные значения величин 1SD для лиц молодого
возраста в указанных зонах равны соответственно 0,102 и 0,136 г/см2. Другими
словами, можно видеть, что послеполетные значения МПКТ в подавляющем большинстве
случаев не выходят за пределы 1SD, принятой по регламенту ВОЗ за нижнюю
границу нормы, а в некоторых случаях потери почти в 2 раза меньше величины
1SD.
На этом основании можно утверждать, что среднегрупповые значения уменьшения
костной массы у космонавтов за полет в сегментах нижней половины скелета,
как правило, не выходят за пределы "нормы", т.е. показатели
МПКТ не уменьшаются ниже 1 SD от значений пиковой костной массы в молодом
возрасте (Т-масштаб по классификации ВОЗ).
Однако индивидуальный анализ позволяет выявить случаи преимущественно
с исходно низкой костной массой у космонавтов, когда снижение МПК в поясничных
позвонках после полета выходит за пределы -1 SD, но не опускается ниже
-2,5 SD по Т-критерию, и это квалифицируется как локальная остеопения.
Весьма вероятно, что в данных случаях имеет место определенная предрасположенность
к остеопорозу [Баранов и др., 2000]. Вместе с тем исходно низкие значения
костной массы можно рассматривать как "индивидуальную норму",
и в таких случаях при квалификации состояния следует не только использовать
Т-критерий, но и учитывать размер изменений в процентах к предполетным
значениям. Можно заметить, что снижение МПКТ у индивидов с исходно низкой
массой не превышает средних значений потерь в группе космонавтов за полет
аналогичной длительности.
3.3.4. Индивидуальные особенности изменений: возможность генетического
прогнозирования
В предыдущей главе были продемонстрированы значительные межиндивидуальные
различия изменений МПКТ и содержания костных минералов после космических
полетов и их обратного развития (см. табл. 3.2). Есть основания думать
о возможной наследственной (генетической) природе этих различий, т.е.
связать их с генетически детерминированными величиной пика костной массы
(максимальные индивидуальные значения в возрасте 20-25 лет) и скоростью
(уровнем) процессов адаптивного ремоделирования костной ткани или костного
метаболизма, что, кстати, объясняет и широту диапазона "нормы".
Литература последнего времени [Беневоленская, Финогенова, 1999а; Баранов
и др., 2000] содержит большое число данных, свидетельствующих о том, что,
по меньшей мере, один из основных предикторов остеопороза - костная масса
(МПКТ) - детерминирован генетически в достаточно высокой степени. Начало
таким исследованиям положила публикация Моррисона [Morrison et al., 1994]
о взаимосвязи между МПКТ и аллельными вариантами генов, кодирующих рецептор
витамина D3 (РВД).
К настоящему времени идентифицирован ряд генов, ответственных за синтез
других белков, формирующих и регулирующих состав костного матрикса - генов,
различные аллели которых ассоциируются с низкой по сравнению с возрастной
нормой МПКТ, с более высокой скоростью потери костной массы, нежели физиологическая
возрастная атрофия кости, и с высоким риском перелома на почве остеопороза.
Речь идет, в частности, о генах, кодирующих синтез коллагена типа 1, коллагеназы,
интерлейкина-6 и, возможно, рецепторов эстрогенов, фактора роста фибробластов,
кальцитонинового рецептора и др.
В группе больных остеопорозом различной этиологии получены результаты,
доказывающие наличие заметной корреляции ОП с присутствием функционально
неполноценного аллеля t гена, кодирующего РВД. Обоснованность прогноза
увеличивается, если генетическое тестирование рецептора витамина D3 дополняется
анализом полиморфизма других кандидатных генов [Баранов и др., 2000].
Другими словами, предрасположенность к остеопорозу имеет полигенную детерминацию.
Можно допустить, что в отмеченных нами единичных случаях значимой локальной
остеопении после космических полетов могла иметь место специфическая предрасположенность,
и ее носители могут принадлежать к определенному адаптивному фенотипу
[Делоне, Солониченко, 1999]. Сегодня мы не располагаем материалом для
описания всех признаков данного фенотипа. Тем не менее, учитывая то, что
в настоящее время пока не существует возможности мониторинга костной массы
непосредственно в полете, было бы заманчиво предположить, что генетический
подход мог бы оказаться продуктивным в разработке проблемы прогноза риска
остеопороза, в том числе у космонавтов. И такие исследования уже начались
в сотрудничестве с лабораторией НИИА и Г им. Д.О.Отта (СПб. Зав. В.С.Баранов).
Понятно, что такой путь сопряжен со значительными сложностями, иногда
принципиального характера. [Беневоленская, Финогенова, 1999б].
Поэтому мы рассматриваем возможность другого подхода, который основан
на том, что стромальные остеогенные клетки-предшественники костного мозга,
продолжающие у взрослого человека участвовать в процессе самообновления
костной ткани, интегрируют и генотипические характеристики индивида, и
фенотипические особенности генов, кодирующих костные белки, т.е. то, что
в совокупности с другими признаками формирует интересующий нас адаптивный
фенотип.
3.3.5. Восстановление костной массы после космических полетов
На основе результатов динамических наблюдений за весь период работы проведен
анализ динамики восстановления МПКТ поясничных позвонков L1-L4 после полетов
продолжительностью 5-14 мес., причем всего использованы наблюдения по
14 полетам с последующей динамикой (рис. 13).
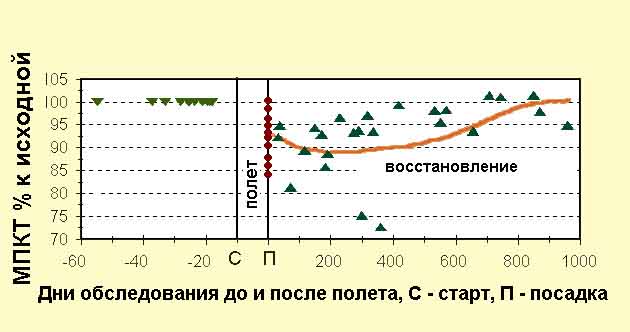
Рис.13. Потеря и восстановление костной массы поясничных позвонков
(L1-L4) после КП длительностью 5-7 месяцев.
Данные, приведенные на рис. 13, подтверждают, что выраженность
изменений за время полета была весьма индивидуальна. Из приведенных данных
видна высокая вариативность изменений в течение первого года после космического
полета. Как показано выше, у части космонавтов наблюдали выраженную отрицательную
динамику транзиторного характера в ранний (3-5 нед.) период реадаптации
(вторичная транзиторная остеопения). На второй и третий год наблюдений
суммарно можно говорить о положительной динамике.
Аналогичные явления вторичной транзиторной остеопении были зарегистрированы
в такие же сроки у добровольцев после 20-суточной [Fukuoka et al., 1997]
и 120-суточной гипокинезии у женщин [Оганов и др., 1997б] и у мужчин [Оганов
и др., 1997а]. Было естественным предположить, что феномен отражает соответствующие
изменения процесса адаптивного ремоделирования костной ткани в ответ на
увеличение ("возвращение") механической нагрузки на скелет в
поле земного тяготения.
Задаваясь целью связать различия в динамике МПКТ в восстановительный период
(ВП) с индивидуальной скоростью ремоделирования, мы изучали у добровольцев
в условиях 120-суточной АНОГ динамику МПКТ, а в ВП наряду с МПКТ - некоторые
биохимические показатели костного метаболизма резорбции (пиридинолин,
дезоксипиридинолин, N-телопептид коллагена и другие продукты его распада
- в моче, тартрат-резистентная кислая фосфатаза, креатинин - в плазме
крови) и новообразования (карбокси- и аминотерминальные пропептиды проколлагена
I типа остеокальцин, костная фракция щелочной фосфатазы - в крови) а также
совместно с лабораторией морфологии (А.С.Капланский) нашего Института
гистоморфометрические показатели интенсивности ремоделирования костной
ткани на 14-е и 30-е сутки ВП и через 1 год после окончания эксперимента
[Оганов и др., 1997а] (ссылка по книге №98 с полным составом авторов).
Суммируя результаты проведенного гистоморфометрического и биохимического
исследований с участием человека в условиях АНОГ, можно констатировать,
что в ранний период реадаптации мы наблюдаем признаки адекватной активации
процесса ремоделирования костной ткани как реакции на "возвращение"
весовой нагрузки в векторе гравитации. Однако, учитывая более высокую
скорость резорбции (2-4 нед.) по сравнению с формированием (3-4 мес.),
вполне вероятна ситуация временного уменьшения костной массы в этот период,
что и регистрируется денситометрически как транзиторная остеопения.
Гипотеза хорошо подтверждается нашими (совместно со специалистами США)
данными исследований после космических полетов (4-6 месяцев), которые
свидетельствуют о полуторократном возрастании активности резорбции по
сравнению с предполетным уровнем (N-телопептиды, пиридинолин деоксипиридинолин).
И лишь через 2-3 недели отмечали признаки активации костеобразования в
виде статистически достоверного повышения содержания специфической костной
щелочной фосфатазы и остеокальцина [Smith et al., 2004].
3.3.6. О возможных механизмах остеопении в космическом полете. Системный
анализ
Памятуя о полиморфной природе костной ткани, можно полагать,
что механизмы ее реакций при изменении внешнего "механического входа",
в частности в космическом полете, следует искать во всей совокупности
ее составляющих: клеточных пулах, внеклеточном матриксе и нанокристаллах
минерального компонента - ее адаптивного ремоделирования в заданных условиях.
При этом следует принимать во внимание фактор перераспределения жидкостных
сред в краниальном направлении, который, запуская корригирующие механизмы
волюмо- и ионорегуляции в организме, вне сомнения видоизменяет и метаболическую
функцию скелета.
Исходя из этих предпосылок, был проведен предварительный анализ возможного
участия различных уровней и контуров регуляции биомеханической и метаболической
функций скелета: внутрикостных, внекостных (тканевых) и иерархии систем
волюмо- и ионорегуляции, сопряженных с эндокринным контролем гомеостаза
кальция [Григорьев и др., 1994]. К первым относится остеоцитарный комплекс,
или остеоциты (ОЦ) и формируемая ими лакунарно-канальцевая сеть, которые
теоретически могут быть главным участником адаптационных перестроек кости
при изменениях внешнего механического поля [Регирер и др., 2000, Корнилов,
Аврунин, 2001].
На возможное участие остеоцитарных механизмов в изменениях костной ткани
в условиях невесомости могут указывать данные, полученные, главным образом,
в опытах с животными, где признаки остеоцитарного остеолиза были описаны
после экспозиции крыс на биоспутниках "Космос 605" [Ягодовский,
Горохова, 1979] и "Космос 1887" [Foldes et al., 1990], правда,
в ранние (2 суток) сроки реадаптации, что не исключает возможности эффекта
"возвращенной" нагрузки.
Более убедительные данные получены в модельных экспериментах (вывешивание
крыс) с помощью специфических маркеров (ферритин, пероксидаза хрена).
Было показано значительное снижение скорости перемещений жидкости (скорости
включения и выведения метки) в эндостальных канальцах и остеоцитарных
лакунах кортикальной кости бедра [Dillaman et al., 1990]. Прямые доказательства
активации остеоцитарной резорбции в процессе полета получены при ультраструктурном
анализе костей обезьян, экспонированных на биоспутнике "Бион-11"
[Родионова, Оганов, 2001].
К числу других внутрикостных механизмов следует отнести систему взаимообмена
Са2+ между кристаллической структурой, лабильным пулом аморфного кальция
и интерстициальной жидкостью, составляющей содержимое каналикуло-лакунарной
сети.
Основными компонентами минерального матрикса являются кристаллический
гидроксиапатит и аморфный фосфат кальция. В аморфном состоянии может находиться
до 50% всех минеральных солей [Корнилов, Аврунин, 2001]. О нарушении их
соотношения в невесомости может свидетельствовать отмеченное нами в опытах
с животными на биоспутниках "Космос" снижение прочности костей
при неизменной их минерализации на ранних этапах полета (до 3-х недель)
[Оганов, Шнайдер, 1997]. Это может быть обусловлено изменениями физико-химических
параметров связи коллагена с кристаллизованными минералами, возможно,
за счет перехода части кальция в аморфное состояние [Ступаков, Воложин,
1989].
Гипотеза получила подтверждение в модельных опытах с животными, где изучали
влияние лишения опоры задних конечностей на характеристики костей крыс
методом электронного парамагнитного резонанса (ЭПР) [Brik et al., 2001].
В образцах костей экспериментальных животных установлено достоверное снижение
количества свободных СО2- радикалов, что может свидетельствовать об изменении
физико-химических характеристик материала кости как минерал-органического
композита [Оганов и др., 2002] и, следовательно, "качества"
кости.
Далее можно предположить, что в ответ на изменение внешней нагрузки параллельно
с реакцией костного матрикса либо с небольшим запаздыванием могут измениться
тканевые (внекостные) потоки кальция, в частности в кишечнике, почках
и крови как отражение перераспределения жидкостных сред организма. Так,
в космических полетах установлено общее уменьшение ёмкости кальций-депонирующих
систем организма [Газенко и соавт., 1986]. В частности, в условиях 24-часовой
АНОГ обнаружены изменения физико-химических свойств крови, сопряженные
со снижением способности белков плазмы связывать ионизированный кальций
[Ларина, 2000]. Получены также данные об уменьшении у космонавтов всасывания
Са в кишечнике и реабсорбции его в почках [Моруков и соавт., 1998; Smith
et al., 1997, 2004].
Описанные изменения, несомненно, связаны и с перестройкой в системе волюморегуляции,
где на разных этапах космического полета регистрируется определенная фазность
развития адаптивных реакций стабилизации гемодинамики и водно-электролитного
гомеостаза [Григорьев, Воложин, Ступаков, 1994; Носков, 2000]. В "острый"
период адаптации к невесомости установлены отчетливые признаки подавления
активности гормонов ренин-ангиотензин-альдостероновой системы (РААС) с
одновременным увеличением экскреции почками жидкости и электролитов. На
этой стадии, как полагают А.Григорьев и соавт. [1994], гиперкальциурия
может создать предпосылки ("гипокальциемический импульс") для
включения механизмов стабилизации концентрации ионизированного Са в крови,
например, в виде повышения содержания паратгормона, и мобилизации Са из
кости по остеокластическому механизму.
Не исключено, что в отсутствии механического стресса происходит торможение
тканевой (паракринной) регуляции дифференциации остеобластов, которая
в обычных условиях стимулируется резорбцией. Это подтверждается данными
об угнетении ранних этапов дифференцировки прекурсорных клеток в ОБ, ex
vivo [Roberts, Mozsary, Morey, 1981] и in vitro [Hughes-Fulford, 2001],
а также о снижении числа функционально активных клеток в популяции зрелых
ОБ - в опытах с животными [Родионова, Оганов, 2003].
Все это может свидетельствовать о снижении коллагенсинтетической функции
ОБ и, следовательно, о замедлении костеобразования в невесомости. На это
же указывают данные о снижении активности биохимических маркеров костеобразования
у космонавтов на определенных этапах полета [Smith., Oganov, Morukov et
al., 1997].
Резюме
Потеря костной массы в невесомости предполагает участие различных уровней
регуляции механической и метаболической функции скелета: собственно костного,
внекостного (тканевого) и системных факторов.
Дефицит механической нагрузки и микродеформаций может сопровождаться:
активацией (в виде пусковой реакции) остеоцитарного комплекса как главного
звена механосенсорной системы костной ткани; замедлением остеобластического
гистогенеза на ранних стадиях дифференциации и снижением скорости формирования
кости; нарушением связи "коллаген-кристалл", формирующей костную
ткань как минерал-органический композит на молекулярном уровне, что сопряжено
с ухудшением "качества" кости.
Не менее важна роль тканевых факторов таких, как снижение кальцийсвязывающей
способности белков крови, всасывания Са в кишечнике и его реабсорбции
в почках.
Перестройки в иерархии систем регуляции водно-электролитного статуса,
вызванные перераспределением жидкостных сред организма в краниальном направлении,
могут провоцировать остеобластно-остеокластическую резорбцию.
Перестройки в иерархии систем регуляции водно-электролитного статуса,
вызванные перераспределением жидкостных сред организма в краниальном направлении,
могут провоцировать остеобластно-остеокластическую резорбцию.
Таким образом можно допустить, что основой формирования дефицита костной
массы в невесомости могут быть изменения на различных уровнях регуляции
костного метаболизма, а именно: активация остеоцитарного остеолизиса;
нарушение связи нанокристаллов минерала с органическим матриксом кости;
замедление адаптивного ремоделирования в части костеобразования; собственно
остеокластическая резорбция, индуцируемая перестройками в иерархии систем
волюмо- и ионорегуляции.
4. Остеопороз и прогнозирование риска перелома костей
Одной из задач настоящей работы в той ее части, которая
касалась клиники остеопороза (ОП), было получение критериев медицинской
квалификации состояний костной ткани человека после космических экспедиций.
Под клиникой ОП здесь подразумеваются исследования, выполненные при динамическом
амбулаторном наблюдении пациентов с ОП и оценке эффективности лечебных
мероприятий.
Остеопороз - заболевание, имеющее различную этиологию и сопровождающееся
уменьшением костной массы, изменением микроструктуры костей и потому сопряженное
с высокой вероятностью переломов костей.
Клиницистам хорошо известно, что дефицит движений может и на Земле стать
причиной этого заболевания. Состояние, возникающее у больных, вынужденных
длительное время находиться на постельном режиме, определяется как "иммобилизационный
остеопороз" [Русаков, 1959].
В гравитационной физиологии подобная ситуация используется для имитации
весовой разгрузки и создания дефицита механической стимуляции скелета
у здоровых людей в виде горизонтальной гипокинезии (постельный режим -
ПР) или с отрицательным отклонением от горизонтали головного конца кровати
(антиортостатическая гипокинезия - АНОГ). Известно, что гипокинезия, или
дефицит движений, двигательной активности, сами по себе сопровождаются
развитием в организме человека явлений, неблагоприятных для его здоровья
[Коваленко, Гуровский, 1980; Тизул, 2001]. Систематические и целенаправленные
исследования этих явлений и их потенциальной опасности для здорового человека
начались сравнительно недавно и были стимулированы, как это ни странно,
не клинической практикой, а получили развитие в рамках космической медицины
и гравитационной физиологии. В упомянутых работах по разным причинам практически
не рассматривались эффекты ПР и АНОГ непосредственно в костной ткани.
Мы суммировали также результаты изучения состояния костной ткани здоровых
добровольцев в условиях экспериментальной гипокинезии (ПР, АНОГ) длительностью
от 20 до 370 сут., которые, как и можно было ожидать, весьма сходны с
результатами, полученными при обследовании космонавтов [Оганов, 2003].
Главное, что мы считаем необходимым выделить в анализе модельных экспериментов
- это то, что с клинической точки зрения обнаруженные потери костной массы
при гипокинезии до 120 сут. по среднегрупповым значениям не выходят за
пределы нормы (в соответствии с Т-критерием ВОЗ) либо в отдельных случаях
квалифицируются как остеопения (значения МПКТ по Т-критерию ниже границы
1 SD по сравнению с пиком костной массы в молодом возрасте). Потери костной
массы при более продолжительной (до года) гипокинезии у отдельных индивидов
могут достигать значений, которые должны квалифицироваться как остеопороз
(значения МПКТ ниже уровня 2,5 SD по Т-критерию).
Параллельно с исследованиями, моделирующими дефицит механической нагрузки,
и учитывая наличие современной аппаратуры, мы начали исследования по эпидемиологии
остеопороза совместно с Институтом ревматологии РАМН.
Одновременно проводили исследование проявлений остеопороза различной этиологии
(амбулаторный прием) пациентов ЭНЦ РАМН, ГУН ЦИТО и на основе личных обращений,
в т.ч. обследовали здоровых людей популяции Московского региона.
Здесь нашими исследованиями обнаружена тревожная тенденция: в случайной
выборке клинически здоровых людей обоего пола (n>600) установлено,
что значения минеральной плотности костей у лиц до 30 лет заметно ниже
популяционной нормы для белого населения США того же возраста. В то же
время значения МПКТ в старших возрастных группах (до 50 лет и старше)
не имели таких отличий. Можно предположить, что данная субпопуляция молодых
людей к моменту обследования (1995г) претерпевала определенные влияния
внешних условий (невысокое качество жизни). Результаты подтверждаются
данными о сниженных значениях МПКТ у молодого населения Северо-западного
региона России [Корнилов и др., 2003]. Можно полагать, что здесь имеет
место задержка формирования костной массы, и это создает высокую вероятность
развития в данном поколении через 20-30 лет остеопороза, опережающего
обычные возрастные границы.
Другой задачей была попытка на основе анализа данных литературы и результатов
собственных исследований оценить возможность прогнозировать риск перелома
костей по результатам остеоденситометрии, с тем, чтобы в итоге определить,
какую опасность для здоровья представляют потери костной массы после космических
полетов.
Основной причиной снижения прочности костей считается уменьшение костной
массы, поэтому попытки прогнозировать последствия ОП для механического
состояния костной ткани в настоящее время ориентированы главным образом
на данные прижизненного измерения костной массы (МПКТ или СКМ) [Cummings
et al., 1993; Passariello et al., 1997; Baran et al., 1998; Риггз, Мелтон,
2000].
Однако в современной литературе возможность наличия прямых соответствий
"минеральная плотность - механика" подвергается сомнению [Риггз,
Мелтон, 2000]. Это лишь подтверждает противоречивость данных, существовавших
на этот счет еще до широкого внедрения в практику неинвазивной остеоденситометрии.
Так, показано, что связь механических свойств костей с минеральной насыщенностью
(МН, г/см3) описывается уравнением степенного типа, так что уменьшение
костной массы (в данном случае МН) сопровождается кратно большим снижением
механических характеристик образцов (предела прочности, модуля упругости,
энергии упругого деформирования) [Ступаков, Воложин, 1989].
С другой стороны, экспериментальные исследования и клинические (патологоанатомические)
наблюдения давали все больше материалов для заключения о том, что потеря
костной массы - важная, но далеко не единственная причина изменения механического
состояния костей. Так, показано, что уменьшение несущей способности костей
с возрастом лишь на 3/4 обусловлено возрастной потерей костной массы [Einhorn,
1988] и в 2-3 раза превышает уменьшение минеральной плотности, отражающее
возрастную потерю костной массы в позвонках [Bartley et al., 1966] и шейке
бедренной кости [Подрушняк, 1984]. По всей вероятности, это обусловлено
полимодальной зависимостью механических свойств костной ткани от ряда
ее биологических и биофизических характеристик [Dequeker, 1994].
Данные литературы подтверждают существенное "перекрытие" значений
минеральной плотности у здоровых людей (возрастная норма) и у пациентов,
имеющих (в связи с ОП) переломы позвонков [Eisman et al., 1991; Krolner,
Nielsen, 1982] или шейки бедра [Griffin, 1990]. Разными авторами независимо
от метода денситометрии указывается довольно широкий диапазон значений
относительного снижения МПКТ (примерно на 30-40 %) в качестве границы
риска травмы [Зацепин и др., 1988; Stevenson, 1988]. Можно полагать, что
эта ситуация в какой-то мере отражает индивидуальную вариабельность генетически
детерминированной величины потери костной массы с возрастом.
Результаты наших исследований пациентов с ОП различной этиологии подтверждают
дискуссионность прогностических оценок по данным остеоденситометрии.
Изучали состояние поясничных позвонков у женщин старше 50 лет (случайная
выборка, n=903) с переломами поясничного позвонка L1 (n=185) без дифференциации
по этиологии ОП. Предварительный анализ представленных результатов показал,
что вероятностный риск переломов позвонков связан не только с минеральной
плотностью, но и с иными "качественными" характеристиками кости,
которые зависят от нозологических форм заболеваний, приводящих к ОП, от
особенностей возрастной физиологии и других факторов.
Так при обследовании женщин с постменопаузальным остеопорозом в выборку
были включены все обследованные женщины в возрасте от 53 до 75 лет при
наличии менопаузы и отсутствии иных заболеваний, приводящих к развитию
ОП. Случаи ранней менопаузы, в том числе хирургической, из выборки исключали.
Всего в выборку было включено 636 случаев, из них 101 случай с компрессионными
переломами поясничных позвонков. Средний возраст обследованных составлял
62,8 ± 5,9 года. Результаты исследования представлены на рис. 14. Как
можно видеть, существенный риск появляется при величинах МПКТ 0,8 г/см2
или в диапазоне от -1 SD до -1,5 SD, составляя примерно 10% случаев с
данным значением МПКТ.
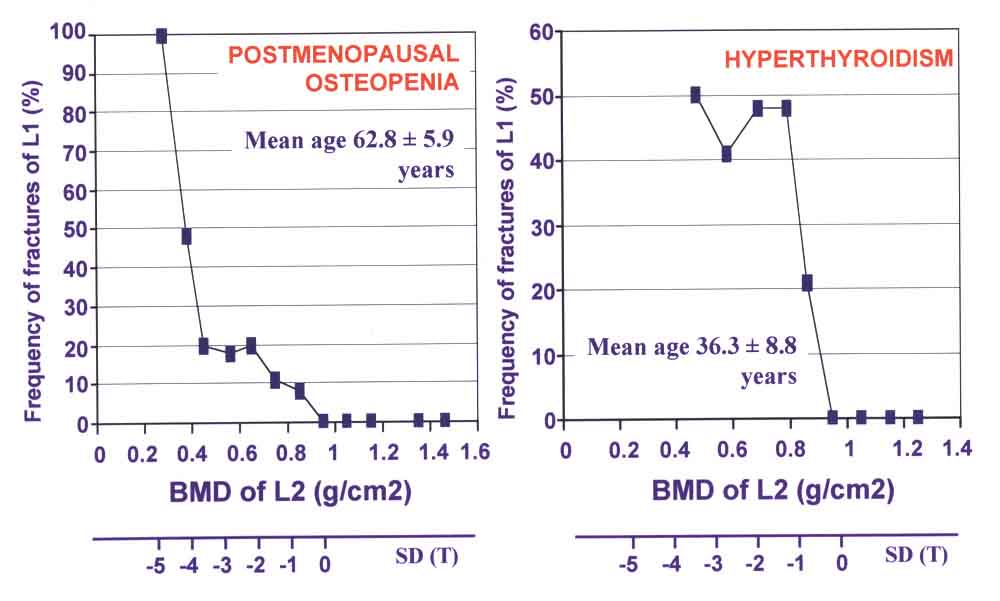
Рис.14. Частота переломов позвонка L1 у женщин в зависимости от плотности
неизмененного L2 при остеопорозе различной этиологии.
При изучении частоты переломов у женщин, больных тиреотоксикозом
учитывали, что нарушения функции щитовидной железы всегда изменяют метаболизм
кости. Тиреоидные гормоны увеличивают остеокластическую резорбцию и при
повышении активности вызывают мобилизацию Са2+ из костной ткани и развитие
остеопороза. Очень часто у больных тиреотоксикозом при проведении денситометрических
исследований обнаруживается ОП, даже если биохимические и рентгенографические
признаки заболевания скелета отсутствуют [Passariello et al., 1997]. Потери
костной массы при тиреотоксикозе развиваются быстро, и, как было показано,
скорость снижения МПКТ поясничных позвонков составляет 9% в год при ятрогенном
гипертиреоидизме, вызванном назначением L-thyroxin при гипотиреозе [Krolner
et al., 1983]. Развитие ОП происходит и в трабекулярной, и в кортикальной
костной ткани.
В выборку были включены больные с тяжелыми симптомами заболевания, находившиеся
в клиниках Российской медицинской академии последипломного образования
МЗ РФ (Москва) и Государственного научного эндокринологического центра
РАМН (Москва). В выборку включены только женщины - всего 227 человек,
в том числе с компрессионными переломами позвонков - 82 человека. Средний
возраст больных составлял 36,3 ± 8,8 года.
Данные о частоте переломов суммированы на рис. 14. При снижении минеральной
плотности L2 до 0,8 г/см2 и ниже частота встречаемости переломов L1 резко
возрастала, что существенно отличалось от распределения при постменопаузальном
и сенильном ОП. Хорошо видно увеличение риска перелома почти в 2-2,5 раза
по сравнению с постменопаузальным ОП при одинаковом уровне снижения МПКТ.
Анализ литературы и результаты собственных исследований подтверждают многочисленные
данные о том, что в статистическом плане механические свойства костей
зависимы от костной массы, поэтому на основе данных остеоденситометрии
возможно лишь вероятностное прогнозирование риска перелома. При этом,
как показано нашими исследованиями, вероятность прогноза будет существенно
зависеть от формы ОП: инволюционного (1-го и 2-го типов) и различных форм
вторичного ОП. В последнем случае, как показано выше, существенное значение
имеет скорость развития болезни (например, тиреотоксикоз) либо, напротив,
какие-то защитные реакции, снижающие вероятность перелома при наличии
явного фактора риска в виде дефицита питания (нервная анорексия) [Чернихова
и др., 2003]. Индивидуальный прогноз осложняется высокой вариабельностью
изменений, формирующих "качество" кости, что, в свою очередь,
существенным образом не только зависит от нозологии, но и определяется
генетическими факторами.
Резюме
Остеопороз - одна из важнейших клинических и социально-экономических
проблем здравоохранения и ддефицит механической нагрузки (невесомость,
гипокинезия, гиподинамия, клиника) - серьезный фактор риска развития остеопороза.
Исследования в клинике остеопороза позволили дать корректную клинико-физиологическую
квалификацию изменений состояния костной ткани в невесомости.
В свою очередь изучение состояния костной ткани в условиях невесомости
существенно обогащает представления о некоторых механизмах развития остеопении
и остеопороза в сходных по этиологической природе ситуациях.
Перспективные направления исследований: изучение механизмов формирования
и изменений "качества кости"; возможности генетического прогнозирования
остеопении; разработка портативных средств мониторинга состояния костной
ткани в длительных космических экспедициях - в равной мере значимы для
гравитационной физиологии костной ткани и костной патологии в здравоохранении.
Заключение
Подводя итоги всему сказанному выше, я возьму на себя
смелость констатировать, что нам удалось за время работы в Институте обнаружить
и объяснить ряд фундаментальных явлений. Здесь я опять-таки имею в виду
сотрудников лаборатории, состав которой преобразовывался в соответствии
с динамикой изучаемых проблем в мышечной системе и костной.
Итак, экспериментально доказано, что изменения в мышечной системе животных
в условиях невесомости являют собой частный случай функциональной пластичности
скелетных мышц. При этом показано, что трансформация их физиологических
свойств хорошо объясняется перепрограммированием протеосинтеза, или изоформ
основных сократительных белков и сменой метаболического профиля мышц (окислительный,
гликолитический).
Далее убедительно показано, что изменения костной массы у человека в космическом
полете, во всяком случае за период 6-7 месяцев полета, как правило, не
выходят за пределы физиологической нормы и рано или поздно (от 1 года
до 3 лет) восстанавливаются.
В пользу физиологической природы этих изменений хорошо свидетельствует
специфическая динамика восстановления, где в большом ряде случаев в ранний
период реадаптации (3-5 недель) наблюдается дополнительная транзиторная
остеопения. Остеоденситометрия и специальные исследования биохимических
маркеров костного метаболизма и гистоморфометрических показателей ремоделирования
после космических полетов и 120-суточной АНОГ показали, что описываемый
феномен отражает нормальную реакцию костной ткани в виде активации адаптивного
ремоделирования в ответ на "возвращенную" нагрузку. На основе
системного анализа данных о вовлеченности различных уровней и контуров
регулирования метаболизма костной ткани в ее реакции на невесомость предложена
гипотеза, согласно которой в основе частичной потери костной массы лежат:
реакции лакунарно-канальцевой сети (остеоцитарный остеолизис), замедление
остеобластического гистогенеза в ответ на дефицит циклической деформации
кости и остеокластическая резорбция, частично спровоцированная изменениями
в системе ионо- и волюморегуляции, сопряженной с эндокринным контролем
кальциевого гомеостаза.
Исследования в гравитационной физиологии костной системы и изучение (наблюдение)
проявлений остеопороза различной этиологии у населения московского региона
оказались взаимообогащающими в смысле понимания природы и механизмов развития
остеодефицитных состояний в близких по генезу условиях.
Заключая, мне хотелось бы искренне поблагодарить сотрудников лаборатории,
самоотверженная работа которых только и позволила получить описанные выше
результаты. Это: С.А.Скуратова, А.Н.Потапов, В.Г.Козлова, А.С.Рахманов,
М.А.Ширвинская, Л.М.Мурашко, В.Я.Климовицкий, Н.М.Ерофеева, Т.А.Чивкунова,
Т.А.Драгунова, О.Е.Кабицкая, В.Е.Новиков, А.В.Бакулин, Е.А.Чернихова,
С.А.Котов.
Я благодарен судьбе за возможность совершенствовать свой профессиональный
уровень, работая с такими замечательными учеными как О.Г.Газенко, А.И.Григорьев,
П.В.Васильев, В.С.Гурфинкель, Г.С.Катинас, С.С.Оганисян.
Мне также приятно с большой симпатией вспомнить зарубежных ученых, сотрудничество
с которыми во многом определяло отдельные направления наших исследований:
В.С.Шнайдер, Л.Шейклфорд, А.Лебланк, Х.Эванс (США), О.Такач, Т.Силади,
А.Сёр, М.Рапчак (Венгрия), С.Козловски, С.Бараньски (Польша), И.Мунье,
М.Фалемпин (Франция), К.Гехт (Германия).
И, завершая эту лекцию, мне хотелось бы отметить, что за 38 лет существования
лаборатории лишь один раз изменилось её название и, что более существенно,
начинали мы свою работу в одной стране и завершаем её в другой, радикально
изменившейся по ментальности и качеству жизни. В этой связи хотелось бы
пожелать нашим более молодым партнерам принять новые обстоятельства нашей
жизни с надеждой. В конце 20-х годов прошлого столетия (тоже иная страна)
Ю.Олеша советовал, что живя в эпоху быстрых темпов и перемен, художник
(человек) должен думать медленно. Последнее необходимо, чтобы (это уже
из Екклезиаста) научиться бороться с обстоятельствами, способными покориться
нам, не ввязываться в борьбу с трудностями, которые мы не сможем преодолеть,
и, что самое главное, суметь отличить одно от другого.
|

