|
РОССИЙСКАЯ АКАДЕМИЯ НАУК
Государственный научный центр РФ - Институт медико-биологических проблем
Доктор медицинских наук, профессор, академик РАМН
В.М.БАРАНОВ

АКТОВАЯ РЕЧЬ
«ДЫХАНИЕ И НЕВЕСОМОСТЬ»
Москва
Октябрь 2006
Основа Двух начал – дыханье:
Вдох и выдох,
И жизнь на том стоит
В многообразных видах.
Ибн Сина
Введение
Исследования функции внешнего дыхания и газообмена, выполненные во время первых полетов человека в космос, не выявили существенных изменений со стороны респираторной системы. Видимо поэтому, многие специалисты в области космической медицины считали, что эта система не играет значительной роли в процессе адаптации организма человека к невесомости и не заслуживает целенаправленного изучения. Первые немногочисленные исследования давали противоречивые результаты, что также не позволяло определить наиболее важные направления, по которым следовало бы вести изучение действия факторов космического полета на функцию дыхания. Однако результаты исследований внешнего дыхания и газообмена в условиях космического полета постепенно накапливались, появились данные, свидетельствующие об участии респираторной системы в механизмах адаптации человека к воздействию невесомости.
Как известно, в космическом полете на организм человека действует комплекс факторов. Основными из них являются: отсутствие действия силы тяжести, гиподинамия и гипокинезия, искусственная атмосфера, повышенный уровень радиации, нервно-эмоциональное напряжение (Газенко, Касьян, 1990; Nicogossian, Huntoon, Pool, 1989). В отличие от остальных факторов, в той или иной мере встречающихся в «земных» условиях, невесомость – сугубо специфический фактор космического полета и в научном плане представляет наибольший интерес.
Пребывание человека в необычных с позиции эволюции условиях вызывает столь же необычный комплекс реакций функциональных систем организма, объяснить который исследователи пытаются, опираясь на имеющиеся данные нормальной и патологической физиологии о механизмах функционирования этих систем при действии силы тяжести.
В настоящее время имеется ряд схем, авторы которых попытались в общем виде представить механизм действия невесомости на организм человека (Касьян, Копанев, 1968; Berry et al., 1970; Генин, Пестов, 1971; Еремин и др., 1974; Пестов, Гератеволь, 1975; Rummel et al., 1979; Коваленко, Касьян, 1983, 1990; Nicogossian et al., 1989; Григорьев и др., 2006). Анализ этих схем, с одной стороны, демонстрирует эволюцию взглядов специалистов на проблему, с другой стороны, позволяет выделить общие особенности в генезе действия невесомости:
- исчезновение гидростатического давления крови и тканевой жидкости и, как следствие, перераспределение жидких сред по направлению к голове;
- отсутствие сил деформации, приводящее к снижению силовой нагрузки на организм и его системы (уменьшение тонуса скелетной мускулатуры, изменение формы эластичных структур, снижение энергетических затрат на преодоление силы тяжести при движениях и т.п.);
- изменение афферентации, в том числе от гравирецепторов.
Рассмотрим значение перечисленных элементов генеза действия невесомости для системы внешнего дыхания и газоэнергообмена.
1.Теоретические и экспериментальные предпосылки к исследованию дыхания в невесомости
В физиологии под термином дыхание понимают совокупность процессов, обеспечивающих поступление в организм кислорода, использование его в биологическом окислении органических веществ, удаление из организма углекислого газа и метаболической воды (Холден, Пристли, 1937; Comroe, 1966; Глебовский, 1977).
В функциональной системе дыхания выделяют внешнее, или легочное, дыхание, осуществляющее газообмен между организмом и средой обитания; кровообращение, обеспечивающее транспорт газов к тканям и от них, а также рациональное распределение крови в организме; кровь как специфическую газотранспортную среду; внутреннее (тканевое) дыхание, осуществляющее процесс клеточного окисления; нейрогуморальный аппарат регуляции дыхания (Канаев, 1980). Являясь частью общей системы дыхания, внешнее дыхание, тесно связанное с другими подсистемами, выполняет конкретную функцию – обеспечивает газообмен между воздухом и кровью, т.е. поддерживает определенный газовый состав крови. Анатомические структуры, обеспечивающие газообмен, можно разделить на две основные части. Это легкие с дыхательными путями и грудная клетка с дыхательными мышцами и диафрагмой (Кадлец, 1967). Ритмические изменения объема легких, происходящие в результате работы дыхательных мышц, обеспечивают постоянную вентиляцию альвеол.
Важной особенностью процессов альвеолярной вентиляции и газообмена является тот факт, что даже в условиях спокойного дыхания у здоровых людей обнаруживается небольшая неравномерность вентиляции (Савицкий, 1940; Briscoe, Cournand, 1959; Шик, 1980) и легочного кровотока (Блинова, Маршак, 1948; Маршак, 1953; Rahn, 1949; Bates, 1965; West, 1965; Зильбер, 1971), которая при некоторых заболеваниях может достичь высокой степени (Cournand et al., 1941; Fowler, 1952; Навратил, 1967). Общепризнано, что гравитация играет важную роль в возникновении регионарных неоднородностей легочных функций (West, Dollerj, 1960; Bryan et al., 1964; Glazier, 1967; Milic-Emili et al., 1966; West, 1966; Дж.Уэст, 1988). Многие авторы отмечали, что у здоровых людей в положении сидя верхние участки легких вентилируются и перфузируются меньше, чем нижние участки (Даум, 1967; Gawer, Znidema, 1961; Raine, 1965). Исследования с использованием радиоактивного кислорода (О215) показали (Dollerj et al., 1961), что исчезновение О215 из верхних отделов легких при вертикальном положении обследуемого происходило медленнее, чем из нижних. В горизонтальном положении этот эффект отсутствовал. Glaister (1965) получил аналогичные результаты, используя другой метод – метод регионарной изотопной топографии Хе133. Он установил, что соотношение кровотока в легких в основании и верхушке равнялось в вертикальном положении 3:1, в горизонтальном 1,3:1, головой вниз 0,7:1. Интересны исследования (Dowell et al., 1969), которые показали, что в горизонтальном положении человека сохраняются различия кровотока, связанные с гравитационным фактором, но проявляются эти различия при положении на спине в увеличении кровотока на единицу объема легких в дорзальных и уменьшении кровоснабжения в вентральных отделах. По данным работ (Riley et al., 1959; Bjurstedt et al., 1962; Anthonisen et al., 1970) 6–14 % альвеол верхних отделов легких вообще не перфузируются кровью у людей в положении стоя. Проведя анализ большого количества работ о связи функции дыхания и гравитации, Белкания (1975) пришел к выводу, что изменения легочного кровообращения при ортостазе зависят от двух факторов: уменьшения перфузии легких, связанного со снижением общего объема циркулирующей крови, и диссоциации регионарного кровотока в результате местного проявления гидростатического эффекта. Fowler (1965) объясняет неоднородность кровотока в легких при вертикальном положении следующими механизмами: пассивным расширением артериол и венул; спадением легочных вен при отрицательных значениях трансмурального давления и, наконец, критическим давлением закрытия капилляров при внутрикапиллярном давлении, превышающем давление в альвеолах.
Наряду с этим существуют и локальные механизмы, направленные на поддержание нормальных вентиляционно-перфузионных отношений, в частности, снижение парциального давления кислорода в каком-либо участке легких вызывает уменьшение кровотока через легочные капилляры этого участка (Маршак, 1961; Fishman, 1961; Парин, Меерсон, 1965; Шерешевский, 1970).
Между работой дыхательных мышц и вызываемой ею вентиляцией легких существуют сложные переменные зависимости, определяемые общими законами механики и свойствами (анатомическими и физиологическими) аппарата внешнего дыхания (Шик, 1973). Оценка анатомо-физиологических свойств системы предусматривает измерение 3 основных параметров: объема, скорости, давления и их отношений, изучением которых занимается специальная область физиологии – механика дыхания (Канаев, 1980). Существует мнение, что отсутствие гравитации нарушает только механическую функцию легких и нет очевидных причин для того, чтобы ожидать каких-либо достоверных изменений клеточного дыхания, диффузионного газообмена или регуляции дыхания под воздействием невесомости (Дитлейн и др., 1984). В этом плане современные знания о механике дыхания представляют интерес для специалистов космической медицины. Следует отметить, что механика дыхания – относительно молодое направление физиологии. Его основоположником принято считать швейцарского физиолога Рорера (Rohrer, 1915, 1916, 1925), который применил общие законы физики для характеристики дыхательного аппарата с учетом его анатомических и физиологических особенностей. Однако бурное развитие исследований механики дыхания началось в конце 1950-х начале 1960-х годов после разработки новых бескровных методов, позволявших определять все основные параметры системы внешнего дыхания (Fleisch, 1956; Du Bois et al., 1956; Jager, 1961). Объемными характеристиками аппарата вентиляции являются статические легочные объемы.
В соответствии с принятой классификацией (Pappenkeimer, 1950; Knowles, 1959) различают четыре емкости легких: общую, жизненную, емкость вдоха и функциональную остаточную, а также четыре первичных легочных объема: дыхательный, резервный объем вдоха, резервный объем выдоха и остаточный.
Для дальнейшего анализа материала о действии невесомости на систему внешнего дыхания представляют интерес работы, в которых показано изменение структуры легочных объемов в зависимости от положения тела, т.е. в зависимости от направления вектора гравитации.
В положении стоя общая емкость легких наибольшая, в положении сидя она уменьшается, а в положении лежа становится наименьшей (Навратил, 1967). Svanberg (1957) показал, что разница в величине общей емкости легких в вертикальном и горизонтальном положении может достигать 1000 см3. Жизненная емкость легких (ЖЕЛ) при положении стоя выше, чем при положении сидя, а сидя — выше, чем лежа (Raclavsky, 1949; Chaudhury, 1968). Подобную направленность имеет и резервный объем выдоха, так как в положении лежа он составляет 20,5 %, в положении сидя
32 %, а в положении стоя — 34 % ЖЕЛ (Кадлец, 1967). По некоторым данным (Bouhuys, Lennep, 1962), функциональная остаточная емкость (ФОЕ) является линейной функцией угла наклона поворотного стола: в положении вверх головой она увеличивается, при наклоне вниз уменьшается. Величина ФОЕ имеет большое значение при изучении механики дыхания, так как она определяется соотношением двух противоположно направленных сил — эластической тяги ткани легкого, стремящейся уменьшить его объем, и эластической силы тканей грудной клетки (Дембо, 1973). Наряду с ФОЕ, главным образом механические свойства легких и грудной клетки формируют величину ЖЕЛ и общей емкости легких. Помимо механических свойств величина функциональной остаточной емкости легких в значительной степени определяется потребностями газообмена, так как увеличение ФОЕ сопровождается увеличением поверхности газообмена (Кузнецова, 1980).
С объемом вентиляции, необходимым для поддержания оптимального газового состава альвеолярного воздуха, тесно связан также дыхательный объем, который вместе с частотой дыхания является множителем произведения, называемого минутным объемом дыхания. МОД — показатель, количественно характеризующий легочную вентиляцию. Между уровнем тканевого метаболизма (скорость потребления тканями кислорода и образования в них углекислоты) и вентиляцией легких существует зависимость, в определенных пределах близкая к линейной. Увеличение скорости потребления кислорода и образования углекислого газа в тканях проявляется в виде увеличения минутного объема дыхания (Бейнбридж, 1927; Ford, Hellerstein, 1949; Смирнов, 1969).
В том случае, когда уровень вентиляции значительно превышает уровень метаболических процессов в организме, развивается состояние, называемое гипервентиляцией. Подробно гипервентиляционный синдром исследован Малкиным и Горой (1990). Для дальнейшего анализа действия факторов космического полета на респираторную систему важно знать следующее.
- Развитие различной тяжести гипервентиляционных состояний у здоровых людей — явление нередкое.
- Профессиональная деятельность космонавта связана со значительным эмоциональным напряжением, которое является одной из причин гипервентиляции.
- Повышенная концентрация химических веществ в атмосфере также в некоторых случаях приводит к гипервентиляции.
- Непроизвольная гипервентиляция часто свидетельствует о несостоятельности нейрогуморальных механизмов автоматической регуляции дыхания и может явиться причиной патологического состояния, вызывающего снижение работоспособности человека.
В практике космической медицины для исследования эффекта перераспределения крови в невесомости и его влияния на различные системы организма широко используют функциональные пробы, при которых происходит изменение условий кровообращения: ортостатическая проба, воздействие отрицательного давления на нижнюю часть тела (ОДНТ), антиортостатическая проба (Какурин и др., 1976; Яруллин и др., 1980; Егоров и др., 1982; Васильева и др., 1983). Большинство авторов исследуют показатели сердечно-сосудистой системы и, в меньшей степени, внешнего дыхания и газообмена, хотя имеются работы, в которых показаны различия в изменениях респираторных показателей до и после космического полета и воздействия моделированной невесомости в ответ на указанные выше пробы. При изучении реакции человека на ортостатическую нагрузку и воздействие ОДНТ после 30-суточного пребывания в условиях орто- (+6о) и антиортостатической (-2о, -6о) гипокинезии было отмечено изменение реакции респираторной системы, проявившееся в гипервентиляции, гипокапнии и нарушении динамики газообмена, что характерно для дыхательного алкалоза и тканевой гипоксии (Савилов, Горнаго, 1975).
Сравнивая ортостатическую пробу и пробу с декомпрессией нижней части тела величиной 30 и 50 мм рт. ст. по изменениям функции дыхания, легочным объемам и энергообмену, Гноевая и Тихомиров (1975) установили, что изменения минутного объема дыхания (МОД) аналогичны таковым при ортопробе. Увеличение происходит за счет дыхательного объема, что, по мнению авторов, свидетельствует об облегчении дыхательного акта. Остальные легочные объемы и емкости при обоих видах воздействия изменяются также в одном направлении, за исключением остаточного объема, который существенно увеличивается при ортопробе и не изменяется при декомпрессии нижней части тела. В связи с этим ФОЕ при ортопробе увеличивается неизмеримо больше, чем при декомпрессии нижней части тела. Авторы связывают эти различия со степенью перемещения диафрагмы (Гноевая, Тихомиров, 1975). Установлено (Михневич, 1939), что при ортопробе диафрагма смещается на 1,8–7 см. При действии ОДНТ диафрагма отклоняется на 1–2 см (Тютин, Волошин. Красных, 1971; Millidge et al., 1967). Уменьшение средней высоты легких на 1,36 см, измеренное рентгенографически при функциональной остаточной емкости, наблюдалось во время кратковременной невесомости при полетах на самолете по параболе Кеплера (Michels, Friedman, West, 1979). Однако авторы объясняют этот факт не отсутствием действия гравитации на грудную клетку и органы брюшной полости, а устранением деформации эластичной ткани легкого, наблюдаемой на Земле под действием его собственной массы. По данным Гноевой и Тихомирова (1975), при пробе с ОДНТ потребление кислорода, как правило, не изменяется в отличие от ортопробы, когда этот показатель увеличивается (Nunneley, 1974). Исключение составляют случаи плохой переносимости декомпрессии. В этих случаях энергетика организма возрастает. Статистически достоверный подъем напряжения кислорода в артериализованной капиллярной крови был установлен у космонавтов при проведении ортопробы до космического полета (Генин, Финогенова, 1982). Во время фонового ортостатического воздействия наблюдали повышение РаО2
с 67,2 ± 1,9 до 74,4 ± 1,28 мм рт.ст. (р < 0,01) и снижение РаСО2 с 40,1 ± 0,9 до 37,4 ± 1,8 мм рт.ст (р < 0,05). В период обследования космонавтов после 7-суточных полетов направление изменений газового состава и кислотно-основного состояния крови оставалось таким же, как и до полета. Статистически достоверные различия во время ортопробы отмечались лишь по уровню PaCO2 и величине истинного бикарбоната. Напряжение углекислого газа в крови снижалось с 38,5 ± 1,5 до 33,7 ± 1,29 мм рт.ст., а величина истинного бикарбоната уменьшалась с 28,3 ± 1,16 до 21,7 ± 0,98 мм рт.ст.
Приведенные Гениным и Финогеновой факты свидетельствуют о том, что пассивный перевод человека из горизонтального положения в вертикальное как в до-, так и послеполетный период сопровождается закономерными сдвигами газового состава и кислотно-основного состояния крови, протекающими по типу компенсированного респираторного алкалоза и возникающими, вероятно, вследствие избыточной альвеолярной вентиляции легких в этих условиях. Панченко и др. (1982) исследовали диагностическое значение динамики показателей дыхания, центрального, легочного и церебрального кровообращения для оценки эффективности действия ОДНТ в условиях перераспределения крови относительно продольной оси тела. Состояние газообменной функции легких, центральной и легочной гемодинамики оценивали по показателям диффузионной способности легких, минутного и систолического объема крови при ОДНТ 30 мм рт.ст. в горизонтальном, антиортостатическом (-30°) и ортостатическом (+85°) положениях, а также при различных величинах ОДНТ (30, 40 и 50 мм рт.ст.) только в антиортостатическом положении. В горизонтальном положении действие ОДНТ вызывало достоверное изменение показателей дыхания и кровообращения, характерное по направленности для ортостатической пробы, но менее выраженное. На основании результатов исследований авторы пришли к выводу, что динамика показателей диффузионной способности легких адекватно отражает перераспределение крови в организме как при постуральных пробах, так и при различных величинах ОДНТ (Панченко, Лапаев, Карпушева и др., 1982).
В настоящее время широкое распространение получил чрескожный, или как его чаще называют, транскутанный, метод определения напряжения кислорода в крови (РчкО2). По мнению большинства исследователей, направленность изменений РчкО2
достоверно отражает в условиях нормоксии динамику артериального РО2, при этом величина РчкО2 на 10–12 % ниже соответствующих значений РаО2 (Konig, Kemter et al., 1977; Fatt, 1977; Fenner et al., 1975; Dennhardt et al., 1976; Peabody et al., 1978; Кобулия, 1979; Pollitzer et al., 1980). Исследования транскутанным методом динамики кислородного режима организма во время пассивной ортопробы показали, что из 46 обследуемых у 32 РчкО2 при ортовоздействии повышалось, у 10 динамика этого показателя носила волнообразный характер, и только у 4 человек РчкО2 после первоначального подъема постепенно снижалось и к концу экспозиции оказывалось ниже фоновых значений (Озерова, Асямолова, Кочетов, 1982). Авторы не нашли разницы между характером изменений напряжения кислорода в верхней и нижней половине тела; в то же время динамика показателя кровотока во время ортопробы была различной в подключичной области и нижней трети бедра. В подключичной области в 1-ю минуту ортовоздействия кровоток снижался, а на бедре возрастал. При возврате обследуемых в горизонтальное положение наблюдалась обратная картина, при этом кровоток на бедре был значительно ниже исходных значений.
При действии ОДНТ исследовали кровоснабжение тканей слизистой оболочки десны и ее кислородное обеспечение при помощи комбинированного реополярографического метода (Вольвач, Коваленко, Пономарев и др., 1985). Было установлено, что в начальной фазе воздействия ОДНТ у всех 5 обследуемых наблюдалось выраженное снижение парциального напряжения кислорода и реографического индекса. У обследуемых с хорошей переносимостью ОДНТ ко 2-й минуте отмечалась четко выраженная компенсаторная реакция сосудистого русла слизистой оболочки десны, которая характеризовалась увеличением изучаемых показателей. У обследуемых с удовлетворительной переносимостью ОДНТ компенсаторные реакции сосудов слизистой оболочки десны либо отсутствовали, либо были незначительными по величине и длительности.
Признавая сходство реакций, вызванных действием ОДНТ и пассивной ортопробой, ряд авторов предложили использовать ОДНТ как функциональную пробу для оценки ортоустойчивости человека (Show et al., 1966; Potanin et al., 1969; Генин и др., 1969; Катковский и др., 1972; Суворов и др., 1976) и средство профилактики ортостатических расстройств, возникающих в условиях невесомости и гипокинезии (Stevens, 1966; Генин, Пестов, 1972; Пестов и др., 1972; Тихомиров, Барер и др., 1976; Катковский, Пометов и др., 1976).
Однако такое воздействие (ОДНТ) вызывает смещение органов брюшной полости, диафрагмы, легких и даже сердца в направлении «голова–таз», увеличивает физиологическое, анатомическое и альвеолярное мертвое пространство, изменяет структуру легочных объемов (Show et al., 1966; Генин и др., 1969, 1983). На наш взгляд, описанные изменения позволяют объяснить более выраженные сдвиги сосудистого тонуса и частоты пульса при ОДНТ по сравнению с таковыми при декомпрессии даже одновременно обеих ног (Стойда, Абрикосова, 1972), не только воздействием на рефлексогенные зоны таза и живота, но и непосредственным воздействием на систему дыхания. Поэтому в экспериментальных исследованиях, проведенных сотрудниками нашей лаборатории (Асямолова, Волков, Котов) с целью уточнения взаимосвязи функции дыхания и эффекта перераспределения жидких сред организма использовали локальное отрицательное давление (ЛОД) на ноги без непосредственного механического воздействия на грудную клетку, диафрагму и органы брюшной полости. В исследованиях с участием здоровых людей-добровольцев изучали реакции сердечно-сосудистой и респираторной систем при различных сочетаниях ортопробы, антиортостатического положения, ЛОД, при гемодинамических сдвигах, вызванных гипогидратацией.
Было установлено, что в горизонтальном положении при действии ЛОД характер изменений показателей легочной вентиляции, газообмена и частоты сердечных сокращений напоминает характер изменений при ортопробе. Возрастает легочная вентиляция (на 13,4 %), главным образом, за счет увеличения дыхательного объема. Несколько повышается уровень энергетического обмена; потребление кислорода возрастает с 237 до 266 мл/мин, увеличивается выделение СО2 с 189 до 213 мл/мин, изменяется дыхательный коэффициент, уменьшается кислородный пульс за счет возрастания ЧСС. Наши результаты совпадают с данными, полученными Длигач, несмотря на то, что при проведении исследований имелись различия в величине декомпрессии, ее продолжительности и положении обследуемого (Литвин, Длигач, 1978; Длигач, Иоффе,1982). Механизмы этих реакций авторы объясняют изменениями метаболизма тканей, подвергающихся локальной декомпрессии. Кроме того, отмечены различия в динамике показателей газообмена при переводе обследуемых из горизонтального положения в антиортостатическое и обратно в сериях с использованием ЛОД и в сериях без его применения. Данный факт имеет определенное значение, так как позволяет сделать вывод, что ЛОД, приложенное к нижним конечностям и в определенной степени моделирующее действие силы тяжести на кровообращение в вертикальном положении тела, вызывает дополнительное напряжение кардиореспираторной системы. Это проявляется в возрастании газообмена и энерготрат.
Необходимо отметить, что и ЛОД, и гиповолемия, вызванная приемом диуретического препарата фуросемида и проявляющаяся в снижении объема циркулирующей крови на 7–9 % (по данным Носкова), потенциировали гидростатический эффект ортопробы. Причем гипогидратация, если судить по таким показателям как МОД, выделение СО2, кислородный пульс, пульсовое давление, оказывала более существенное влияние на ортоустойчивость, чем ЛОД -40 мм. рт.ст. Анализ газов в альвеолярном воздухе и крови во время ортопроб показал, что на фоне воздействия ЛОД и гипогидратации происходит уменьшение напряжения углекислого газа в артериализированной крови на 2–2,5 мм рт.ст.
При ортопробах регистрировали также напряжение кислорода в крови транскутанным методом (РчкО2). Динамика усредненных значений РчкО2 во время ортопроб различных экспериментальных серий показана на рис. 1.
Представленные графики свидетельствуют о том, что в серии, когда ортостатическому воздействию предшествовало часовое пребывание обследуемых в горизонтальном положении и 30-минутное в антиортостатическом под углом 30°, отмечался умеренный рост РчкО2 в первые 2 минуты воздействия, а затем происходило его уменьшение почти до фоновых значений. В сериях, когда ортопроба дополнялась действием ЛОД или проводилась на фоне гипогидратации, характер первичной реакции на начало ортостаза был аналогичен реакции в контрольной серии, но потом происходило постепенное увеличение
DРчкО2 до конца ортовоздействия (20 мин). Наиболее выраженным был прирост РчкО2 в серии, где во время ортовоздействия использовали не только ЛОД, но обследуемые дышали также через дополнительное мертвое пространство. При этом используемое нами дополнительное мертвое пространство в виде цилиндрической трубки диаметром 28 мм и объемом 500 мл, вызывало в покое приблизительно 2-кратное увеличение вентиляции.
Анализ индивидуальных кривых изменения РчкО2 во время ортопробы показал, что увеличение прироста этого показателя в процессе всей ортопробы характерно для лиц со сниженной ортостатической устойчивостью.
Рис. 1. Динамика парциального напряжения кислорода (РчкО2) в подключичной области
во время ортопробы после антиортостатического положения (1), на фоне действия
локального отрицательного давления (2), сочетанного действия ЛОД и дополнительного
«мертвого» пространства (3), а также на фоне гипогидратации

При разработке системы комплексной оценки функции внешнего дыхания и газообмена в условиях невесомости с целью использования соответствующих критериев при медицинском контроле состояния здоровья космонавта необходимо исследовать информативность каждого показателя, характеризующего состояние того или иного этапа газообмена. Важным этапом газообмена является переход дыхательных газов через альвеолокапиллярную мембрану. В практике клинической физиологии дыхания данный процесс принято оценивать по показателю диффузионной способности легких. При этом существует мнение, что исследование диффузионной способности является методом ранней диагностики некоторых форм патологии легких (Канаев, 1980). В связи с этим нами совместно с сотрудниками лаборатории «Клинической физиологии дыхания» ВНИИ пульмонологии Минздрава СССР (Генин, Баранов, Котов, Клемент, Кузнецова, Котегов, 1985) были проведены исследования диффузионной способности легких и параметров внешнего дыхания у здоровых лиц и лиц с ранними признаками неспецифических заболеваний легких во время моделирования эффекта перераспределения крови, присущего невесомости.
Диффузионная способность легких (ДЛсо) определялась с помощью аппаратурного комплекса фирмы Jaeger методом одиночного вдоха с задержкой дыхания и методом «устойчивого состояния».
У здоровых мужчин исследования проводили в горизонтальном и антиортостатическом положении (АНОП, -30°) как без дополнительных воздействий на систему кровообращения (контроль), так и с использованием ЛОД на обе ноги и на фоне гипогидратации. У больных с ранними признаками неспецифических заболеваний легких с нарушениями бронхиальной проходимости и без таковых диффузионную способность определяли в положении сидя, лежа на спине и антиортостатическим положении (-8°) в течение 15 минут.
Таблица 1
Динамика диффузионной способности легких, жизненной емкости
и альвеолярного объема при различных воздействиях
|
Показатель |
Положение тела |
|
Контроль |
ЛОД на
ноги |
Гипогидратация |
|
горизонт |
АНОП |
горизонт |
горизонт |
АНОП |
горизонт |
АНОП |
горизонт |
|
DLCO,мл/ мин/
мм рт.ст.
|
23,9 ± 3,27 |
27,3 ± 1,60 |
22,8 ± 1,76 |
24,5 ± 1,3 |
24,7
± 1,2 |
22,9 ± 1,4 |
27,2 ± 1,3 |
22,5 ± 0,6 |
|
VC, л |
4,9 ± 0,3 |
4,7 ± 0,28 |
4,87± 0,3 |
4,9 ± 0,05 |
4,86 ± 0,02 |
4,9 ± 0,07 |
4,9 ± 0,04 |
4,9 ± 0,11 |
|
VA, л |
6,9 ± 0,49 |
7,1 ± 0,6 |
6,9 ± 1,76 |
24,5 ± 0,62 |
7,1 ± 0,1 |
7,1 ± 0,3 |
7,1 ± 0,2 |
7,2 ± 0,1 |
В контрольной серии (табл. 1) при переводе обследуемых из горизонтального положения в антиортостатическое (-30°) наблюдалось увеличение диффузионной способности легких на 14 %. После 30-минутного пребывания в АНОП обследуемых переводили в горизонтальное положение, при этом ДЛco снижалась на 19,7 % (р < 0,1), т.е. возвращалась к фоновому уровню.
У обследуемых в сериях с гипогидратацией ДЛсо определялась в антиортостатическом положении после кратковременного горизонтального положения, и было обнаружено совпадение величины ДЛco в данных сериях с контрольной (27,2 и 27,3 мл/мин/мм рт.ст. соответственно). Перевод обследуемых из АНОП вновь в горизонтальное положение сопровождался снижением диффузионной способности легких в такой же степени как и в контрольной серии (20,8 %, р < 0,05).
Полученные результаты совпадают с данными других авторов (Bates et al., 1956; Котов, 1977; Канаев, 1980), которые объясняют увеличение ДЛco улучшением вентиляционно-перфузионных отношений за счет лучшей перфузии базальных и в большей степени апикальных зон легких. Более значительное увеличение ДЛco во время 30-минутного АНОП, на наш взгляд, можно также объяснить повышением давления в сосудах малого круга кровообращения, увеличением перфузии вентилируемых альвеол, что и приводит к увеличению ДЛco.
У обследуемых в сериях, когда применяли ЛОД на ноги, диффузионная способность легких не изменялась при переводе из горизонтального положения в АНОП (24,5 и 24,7 мл/мин/мм рт.ст. соответственно). При возвращении в горизонтальное положение после 30 мин АНОП было отмечено, хотя и недостоверное, снижение диффузионной способности легких на 7,3 %. Такая динамика ДЛco при постуральных воздействиях с нашей точки зрения объясняется действием ЛОД, которое препятствует перераспределению крови в организме и тем самым нивелирует эффект постурального воздействия.
При определении ДЛco у больных с ранними проявлениями неспецифических заболеваний легких, имеющих признаки нарушения бронхиальной проходимости, было обнаружено, что изменение положения тела не сопровождалось динамикой ДЛco. Причина отсутствия динамики ДЛco на постуральные воздействия в этой группе больных может заключаться в нарушении условий вентиляции, в результате чего не происходит увеличение поверхности функционирующих альвеол.
Подтверждением такого объяснения являются результаты исследования диффузионной способности легких у группы больных без нарушения бронхиальной проходимости. В этой группе, несмотря на сниженные величины ДЛco в положении сидя (по отношению к должным), была отмечена ее динамика при переводе больных в горизонтальное и антиортостатическое положение. Это означает, что отсутствие нарушений бронхиальной проходимости позволяет в АНОП увеличить площадь диффузии. Таким образом, диффузионная способность легких является информативным показателем для системы комплексной оценки функции дыхания в условиях. моделирующих такой эффект невесомости как перераспределение крови.
Главная функция легких, как уже упоминалось, заключается в поддержании определенного состава газов крови, причем, несмотря на значительные колебания поглощения кислорода в организме и выделения из него углекислого газа, напряжение О2 и СО2 в крови в норме достаточно постоянно. Соответствие легочной вентиляции интенсивности метаболических процессов в организме обеспечивается сложной системой регуляции. Информация от различных рецепторов поступает в дыхательный центр (центральный регулятор), где она обрабатывается и выдаются команды дыхательным мышцам (эффекторам). Работа мышц приводит к изменению вентиляции, а это, в свою очередь оказывает влияние на рецепторы. Нарушение в каком-нибудь одном звене приведет к нарушению всей «системы управления». Вместе с тем условия космического полета могут вносить «возмущения» в систему регуляции в каждом его элементе.
Хеморецепторный контур регуляции дыхания в космическом полете может подвергаться воздействию таких экзогенных и эндогенных факторов, как гиперкапния и гипероксия, гипоксия и гипоксемия, гипотермия и гипертермия, метаболические сдвиги рН и др.
Основным механизмом системы регуляции дыхания принято считать гиперкапническую и гипоксическую стимуляцию дыхательного центра (Гейманс, Кордье, 1940; Маршак, 1961, 1969; Крылов, 1966; Бреслав, Глебовский, 1981; Бреслав, 1984). Главную роль при этом играет гиперкапническая стимуляция, способствующая учащению импульсации как инспираторных, так и экспираторных нейронов (Сергеев, 1982, 1983 и др.). В условиях гипокапнии ритмическая активность инспираторных нейронов вообще исчезает (Кулик, 1967; Sears et al., 1982 и др.). Однако перечисленные выше факторы могут изменять чувствительность дыхательного центра к хеморецепторным стимулам. Кроме того, состав жидкости, омывающей центральные хеморецепторы, зависит от состава спинномозговой жидкости, локального кровотока и метаболизма, а они в свою очередь могут меняться при изменении условий кровообращения.
Имеющиеся данные (Исеев и др., 1988) о снижении чувствительности дыхательного центра к CO2 в условиях моделированной невесомости (антиортостатическая гипокинезия длительностью 370 суток позволяют высказать предположение о снижении вентиляторной чувствительности к гиперкапническому стимулу в реальной невесомости и в связи с этим о возможной неадекватной реакции системы дыхания на физическую нагрузку.
Что касается других рецепторов, то следует упомянуть о юкстакапиллярных рецепторах (J-рецепторы, которые расположены, как принято считать, в стенках альвеол около капилляров и которые могут реагировать на переполнение кровью легочных капилляров и повышение объема интерстициальной жидкости. Некоторые исследователи связывают с J-рецепторами возникновение одышки.
Кроме того, раздражение артериальных барорецепторов вследствие увеличения артериального давления может приводить к рефлекторной гиповентиляции, а понижение артериального давления – к гипервентиляции. Раздражение рецепторов носовой полости и верхних дыхательных путей вызывает чихание, кашель и сужение бронхов; последнее весьма важно, если иметь ввиду известный симптом невесомости: отечность тканей головы.
Результирующими эффекторами дыхания являются дыхательные мышцы – гравитационно-зависимые функциональные структуры, работа которых постоянно сопряжена с преодолением эластических сил легких и грудной клетки, веса органов грудной и брюшной полостей.
Отсутствие веса этих органов ведет к изменению эластического напряжения грудной клетки и ее конфигурации, в результате чего изменяются оптимальные соотношения длины и пространственной ориентации дыхательных мышц, нарушается биомеханика их сокращений, что может способствовать утомлению дыхательной мускулатуры и возникновению диспноэ, а также ослаблению проприоцептивных влияний на дыхательный центр.
Непрерывная ритмическая деятельность дыхательных мышц и особенно диафрагмы в системе дыхания по своему значению и характеру может быть сравнима с работой сердечной мышцы в системе кровообращения. Морфологические характеристики дыхательных мышц аналогичны таковым скелетной мускулатуры. Поэтому отмеченные морфофункциональные параллели позволяют предположить, что дыхательные мышцы, как и скелетные, подвержены астенизирующему и детренирующему влиянию длительной невесомости. Это предположение подтверждается результатами ряда экспериментальных исследований. Установлено, что снижение максимальной аэробной работо-способности, возникающее после антиортостатической гипокинезии продолжи-тельностью более 4 недель, обусловлено не только уменьшением кислород-транспортных возможностей сердечно-сосудистой системы, но и снижением функциональных резервов системы дыхания, ее неспособностью обеспечить объем вентиляции, адекватный возрастающей нагрузке. Предполагается, что наиболее вероятной причиной этой несостоятельности респираторной системы являются функциональный дефицит дыхательной мускулатуры, ее утомление, возникающее в результате детренирующего влияния гипокинезии (Мачинский, 1988).
Дыхательные мышцы играют большую роль в приспособлении организма к физическим нагрузкам. Поэтому прогнозируемая дисфункция дыхательных мышц может иметь негативное влияние на физическое состояние и работоспособность операторов в условиях космических полетов, особенно длительных, в том числе в ситуациях, связанных с интенсивным мышечным напряжением, таких как внекорабельная деятельность и воздействие гравитационных перегрузок на этапе спуска, а также в период реадаптации к земной гравитации. Поэтому исследования функционального состояния дыхательной мускулатуры, несомненно, актуальны, представляют интерес для теории космической медицины и имеют практическое значение для медицинского обеспечения длительных космических полетов, так как позволяют не только понять природу дисфункции, но и способствовать разработке специальных методов профилактики детренированности и реабилитации дыхательной мускулатуры.
С точки зрения контроля вентиляции, очень важна согласованная работа всех групп дыхательных мышц. Нарушение такой координации, наблюдаемое иногда у новорожденных детей чаще во время сна, может приводить к угнетению дыхания вплоть до его остановки (Abren e Silva et al., 1985; Miller et al.,1988).
В последнее время проблеме регуляции дыхания во время сна посвящается большое число исследований, результаты которых играют важную роль в понимании возможности нарушений функции респираторной системы в космическом полете. Обобщая результаты многочисленных исследований, можно сделать вывод, что особенности дыхания во время сна характеризуются прежде всего ослаблением активности центрального дыхательного механизма, управляющего как респираторной мускулатурой, так и мышцами верхних дыхательных путей. В итоге может нарушаться поддерживаемая в бодрствующем состоянии стабильность связей в системе регуляции дыхания и, как следствие, стабильность дыхательного паттерна.
Центральный дыхательный механизм, регулируя общий уровень вентиляции легких, осуществляет это путем регуляции отдельных компонентов, из которых слагается вентиляция: частоты дыхания, длительности фаз вдоха и выдоха, величины дыхательного объема. Получая информацию от механорецепторов, восприни-мающих величину растяжения легких (рефлекс Геринга – Бройера), скорости потоков воздуха в верхних дыхательных путях и бронхах, дыхательный центр устанавливает такой режим дыхания, при котором не только обеспечивается адекватный метаболизму уровень вентиляции, но и затрачивается минимум энергии (Бреслав, 1985).
Важное значение для анализа получаемой информации о состоянии системы внешнего дыхания имеет понятие о ее недостаточности. Под недостаточностью внешнего дыхания принято понимать такие нарушения, которые не обеспечивают нормальный газовый состав артериальной крови или состояния, при которых нормальный газовый состав достигается за счет включения компенсаторно-приспособительных механизмов, приводящего к снижению функциональных возможностей организма (Дембо, 1957). Резервы аппарата внешнего дыхания, обеспечивающего вентиляцию легких, велики. Так, в покое частота дыхательных движений близка у взрослого здорового человека к 16 в 1 мин, дыхательный объем к 0,5 л, МОД соответственно к 8 л/мин. При максимально возможном произвольном усилении вентиляции легких (МВЛ) частота дыхания может возрасти до 50–80 в 1 мин, дыхательный объем до 2–4 л, а МОД до 100–200 л/мин. Предельные величины МОД лимитируются теми усилиями, которые надо затратить для выполнения резко возрастающей с увеличением МОД работы дыхательных мышц (Шик, 1973). Кислородная стоимость работы дыхания в покое составляет 4–8 мл О2 в 1 мин, а при физической работе, при которой МОД увеличивается до 140 л/мин, она увеличивается до 500 мл О2 в 1 мин (Otis, 1964; Comroe, 1966; Кадлец, 1967). Приведенные работы показывают, что работа дыхания, незначительная по затратам энергии в условиях покоя, резко возрастает при увеличении легочной вентиляции. То же происходит при увеличенном эластическом или неэластическом сопротив-лении дыханию и особенно при сочетании обоих этих факторов (Шик, 1973).
Таким образом, концептуальный прогноз влияния условий жизнедеятельности космонавтов во время длительного космического полета на респираторную систему, основанный на результатах ранее выполненных исследований и теоретических предпосылках, допускает возможность развития в процессе адаптации к этим условиям функциональных изменений следующих показателей:
- биомеханики дыхания;
- диффузии газов и вентиляционно-перфузионных отношений в легких;
- регуляции дыхания и функционального состояния дыхательных мышц;
- состояния гидратации и кровенаполнения легких;
- кислотно-основного состава и газов крови.
Главными факторами, которые способны повлиять на функцию дыхания в космическом полете являются:
- увеличение кровенаполнения сосудов легких вследствие перераспре-деления крови и жидких сред организма в невесомости;
- исчезновение гравитационной неравномерности перфузии легких;
- отсутствие воздействия силы тяжести на структуру легких, грудную клетку и диафрагму;
- снижение уровня двигательной активности и изменение тонуса скелетной мускулатуры;
- изменение состояния регуляторных систем организма;
- искусственная атмосфера и другие факторы обитаемости гермообъектов.
2.Внешнее дыхание и газообмен у космонавтов в невесомости
Выше было высказано предположение, что в процессе адаптации космонавтов к невесомости такая важная функция организма, как респираторная, т.е. процесс доставки и утилизации кислорода, а также выделение продуктов, образующихся в результате окисления, или какой-то этап процесса дыхания будут протекать в невесомости не так, как на Земле. Многие современные исследователи предполагают существенную роль легких и малого круга кровообращения в развитии реакций, связанных с действием на человека динамических факторов космического полета (Wood et al., 1963, 1965, 1971; Генин, Волошин и др., 1969; Юганов, Дегтярев, Нехаев и др., 1977). Сравнительно низкое давление в легочной артерии и малая плотность легочной ткани при относительно больших размерах создают предпосылки для депонирования крови в легких во время невесомости и нарушений, оптимальных для газообмена вентиляционно-перфузионных отношений при гравитационных нагрузках (Barr, 1963; Wood, Hofman, 1984).
Поэтому исследование изменений показателей внешнего дыхания в процессе адаптации к невесомости является важной задачей для уточнения характера этих изменений, выяснения механизмов их возникновения, а также для определения роли системы дыхания в общем процессе адаптации.
Исследования системы внешнего дыхания во время космических полетов начались в полете Ю.А.Гагарина (Волынкин и др., 1962). Во время первых полетов регистрировали только частоту дыхания (ЧД). Начиная с полета космического корабля «Восход-2» количество регистрируемых параметров увеличилось: стали определять жизненную емкость легких и легочную вентиляцию (Воронин, Генин и др., 1967; Касьян, Макаров, Неумывакин и др., 1969; Касьян, Макаров, 1974). По данным авторов, ЧД, зарегистрированная у космонавтов кораблей «Восток», «Восход», «Союз» в период 4-часовой и 5-минутной готовности к полету была выше исходной, что авторы объясняют предстартовым нервно-психическим возбуждением. В начальный период полета ЧД еще несколько повышалась, а в дальнейшем снижалась и к 5-м суткам полета устанавливалась на предстартовом уровне (Касьян, 1983). Однако у некоторых космонавтов ЧД превышала исходную на всех этапах полета. При выполнении более продолжительных космических миссий на ОС «Салют» (до 185 суток) ЧД у космонавтов в состоянии относительного покоя на протяжении всего полета продолжала оставаться выше уровня, наблюдаемого у человека в условиях Земли. Во время физической нагрузки как при кратковременных, так и при длительных полетах ЧД была выше значений, зарегистрированных при выполнении той же работы до полета (Касьян, Макаров, 1984). Наряду с этим было отмечено, что в длительных полетах при регулярной тренировке на велоэргометре наблюдается тенденция к уменьшению ЧД во время выполнения одинаковой по величине нагрузки (Касьян, 1983).
Изменения жизненной емкости легких (ЖЕЛ) в невесомости по данным российских авторов имели разнонаправленный характер. Величина ЖЕЛ существенно не отличалась от значений, зарегистрированных на Земле, хотя в большинстве случаев имелась тенденция к уменьшению ЖЕЛ у космонавтов в невесомости. Аналогичные результаты были получены американскими исследователями при изучении системы внешнего дыхания астронавтов на ОС «Скайлэб» (Michel et al., 1974). Авторы считают, что снижение ЖЕЛ в невесомости является результатом комбинации ряда факторов, среди которых приоритет отдают смещению диафрагмы в верхнюю половину тела, переполнению малого круга кровообращения вследствие перераспределения крови и пониженного давления атмосферы в ОС «Скайлэб».
Послеполетные обследования космонавтов, совершивших 2–18-суточные полеты на кораблях «Союз», проведенные в основном в 1-е сутки после возвращения на Землю, не выявили какой-либо закономерности в изменениях ЖЕЛ (Щиголев, Пометов, 1975).
Если принять за основу точку зрения Дембо (1973), что нельзя придавать значение изменениям фактической жизненной емкости, не превышающим ±150–200 мл, то результаты, полученные Щиголевым и Пометовым, можно представить следующим образом: у 6 из 19 обследованных космонавтов наблюдали повышение ЖЕЛ после полета по сравнению с предполетными значениями, у 9 космонавтов не отметили ее изменения, а у 4 зарегистрировали ее снижение, в том числе у Николаева, совершившего самый продолжительный для кораблей «Союз» полет (18 суток).
Что касается легочной вентиляции, то большинство исследователей констатируют в невесомости ее увеличение в состоянии покоя (Касьян, 1968; Касьян, Макаров, Соколов, 1971; Michel et al., 1974; Thornton, Rummel, 1974). Закономерное возрастание минутного объема дыхания, потребления кислорода и выделения углекислого газа во время послеполетного обследования было установлено у всех космонавтов, совершивших 2–16-суточные космические полеты на кораблях «Союз» (Щиголев, Пометов, 1975).
У Севастьянова и Николаева, совершивших 18-суточный полет, при обследовании на 2-е сутки после приземления отмечали иную динамику изучаемых показателей. Потребление О2 у командира корабля снизилось с 266 (предполетное значение) до 210 мл/мин, а у бортинженера оставалось на исходном уровне. Минутный объем дыхания снизился у Николаева с 5,2 л до 4,6 л и не изменился у Севастьянова. Подобную динамику показателей газообмена и внешнего дыхания авторы связывают со строгим режимом реабилитационных мероприятий, в основе которых лежало существенное ограничение двигательной активности космонавтов, и со слабо выраженными в этот период реадаптационными процессами (Щиголев, Пометов, 1975).
Исследования легочной вентиляции у космонавтов во время космических полетов проводили не только в состоянии покоя, но и при выполнении физических нагрузок. Анализ опубликованных работ показывает, что в невесомости на характер изменений легочной вентиляции во время физических упражнений влияет вид нагрузки. При измерении легочной вентиляции после выполнения упражнений с эспандером было установлено увеличение МОД по сравнению с предполетными значениями у членов экипажа «Союз-4, -7, -9», «Салют-3». Уменьшение легочной вентиляции зарегистрировали у космонавта Волкова («Салют») после выполнения приседаний с притяжением резиновыми амортизаторами (Касьян, Макаров, 1974). По данным американских исследователей (Michel et al., 1974; Thornton et al., 1974), изменения легочной вентиляции на физическую нагрузку, выполняемую в невесомости по сравнению с данными, полученными при выполнении той же работы до космического полета, в большинстве случаев направлены в сторону снижения. Так у 2 астронавтов ОС «Скайлэб-4» легочная вентиляция во время работы на велоэргометре с нагрузкой, составляющей 70 % от максимальной аэробной способности, была меньше предполетных значений: у командира на 2,4 л/мин, у пилота на 7,9 л/мин. Уменьшение легочной вентиляции американские исследователи объясняют эффектом тренировки.
Помимо упомянутых показателей внешнего дыхания следует остановиться на результатах работ по изучению напряжения кислорода в поверхностных тканях космонавтов — конечном звене процесса газообмена (Вацек, Коваленко, Бобровницкий и др., 1979; Коваленко, Вацек, Хаазе и др., 1982; Вацек и др., 1985). Во время космических полетов средний уровень напряжения кислорода (РО2) в коже руки у космонавтов снижался до 30 ± 3,0 мм рт.ст. по сравнению с уровнем предполетного исследования (40 ± 0,8 мм рт.ст.), а средняя скорость снижения РО2
в тканях во время пробы с пережатием сосудов (ППС) уменьшалась с 13 ± 0,3 до 8,7 ± 0,98 мм рт.ст./мин. Изучение кислородного режима у космонавтов во время длительных полетов показало, что в среднем во время длительных полетов происходит большее изменение показателей кислородного режима периферических тканей по сравнению с кратковременными полетами. При этом в длительных полетах РО2
уменьшалось до 25,6 ± 4,0 мм рт.ст., а скорость снижения парциального напряжения кислорода во время ППС до 7,7 ± 1,3 мм рт.ст./мин; в кратковременных полетах уровень РО2
составил 38 ± 3,3 мм рт.ст., а скорость снижения парциального напряжения кислорода — 10 ± 1,0 мм рт.ст./мин (Коваленко и др., 1982). Хотя установленные сдвиги не выходят за пределы найденных исследователями уровней кислородного гомеостаза организма (Вацек и др., 1985), они могут иметь под собой материальную основу. Изучая различные этапы биологического окисления в мышечной ткани у крыс после 18-суточного космического полета на биоспутнике «Космос-936», (Маилян, Буравкова, Кокорева, 1982) установили, что при инкубировании митохондрий в присутствии различных субстратов окисления скорость дыхания в полетной группе значительно ниже, чем в синхронной, т.е. в группе крыс, находящихся в макете биоспутника на Земле.
Еще более резкое угнетение дыхания в полетной группе было выражено после добавления в ячейку АДФ. Возникающее при этом фосфорилирующее дыхание сопряжено с аккумуляцией энергии в макроэргических соединениях. Учитывая, что АДФ-зависимое дыхание является биохимической моделью работающей мышцы (Кондрашова, 1973), авторы приходят к выводу, что ингибирующее влияние невесомости на дыхание и биоэнергетику мышц особенно сильно проявляется при мышечной работе (Маилян и др., 1982).
В ранний период реадаптации наряду со снижением параметров аэробного дыхания установлено ослабление интенсивности анаэробных гликолитических процессов. Об этом может свидетельствовать снижение активности общей лактатдегидрогеназы в полетной группе на 47 % по сравнению с синхронной группой и на 52 % по сравнению с данными контрольной группы.
Следует отметить, что кратковременное (в течение 5 суток) действие невесомости, в отличие от 20-суточного космического полета не вызывает изменений в энергетических реакциях смешанных скелетных мышц у крыс (Маилян и др., 1985).
Для уточнения происходящих изменений респираторной функции в невесомости мы провели определение параметров внешнего дыхания у космонавтов советско-вьетнамской и советско-кубинской экспедиций посещения ОС «Салют-6». Исследования осуществляли при помощи прибора «Пневмотест-78», изготовленного специалистами ГДР в рамках программы «Интеркосмос» и позволяющего определять МОД, ЧД, ЖЕЛ и РОВ.
Таблица 2
Средние значения МОД (л/мин) космонавтов советско-вьетнамского экипажа
при работе на велоэргометре
|
Период исследования |
Космонавт |
|
КЭ |
КИ |
|
покой |
нагрузка |
покой |
нагрузка |
|
До полета
|
5,68 ± 0,26 |
47,45 ± 0,95 |
7,62 ± 0,14 |
41,40 ± 0,71 |
|
В полете |
7,60 ± 0,18 |
43,35 ± 0,81 |
8,52 ± 0,17 |
31,95 ± 1,38 |
|
Достоверность различия |
p <
0,001 |
p <
0,1 |
p <
0,01 |
p <
0,05 |
Исследования проводили в состоянии относительного покоя, при работе на велоэргометре, создании отрицательного давления на нижнюю половину тела (ОДНТ) и при наложении специальных пневматических манжет на бедра (ИДН — избыточное давление на ноги) в период со 2-х по 6-е сутки пребывания в невесомости.
МОД и ЧД в состоянии относительного покоя и при работе на велоэргометре определяли во время полета космонавтов советско-вьетнамского экипажа (табл. 2).
Было установлено, что во время полета в состоянии относительного покоя у обоих космонавтов МОД увеличен по сравнению с данными предполетного обследования, а при работе на велоэргометре МОД имеет большие значения на Земле, чем при работе с той же нагрузкой в невесомости.
Увеличение легочной вентиляции в состоянии покоя в невесомости ранее было отмечено у космонавтов (Касьян и др., 1971), а также у 6 из 9 астронавтов, работавших на ОС «Скайлэб» (Michel et al., 1974). При этом у всех членов 3-го экипажа ОС «Скайлэб» наблюдали статистически достоверное увеличение МОД, который оставался повышенным во время послеполетных проб у второго пилота и космонавта-исследователя.
При работе на велоэргометре у большинства астронавтов отмечалось снижение потребления кислорода. Американские исследователи относят полученный результат за счет эффекта тренировки, однако в наших исследованиях тренировки к работе на велоэргометре в невесомости не было. Видимо, для объяснения этого явления необходим подробный биомеханический анализ работы, выполняемой космонавтом на велоэргометре в невесомости. Однако на основании наших данных одной из причин указанного явления можно считать уменьшение энергетических затрат на перемещение собственных частей тела.
ЧД в состоянии относительного покоя так же, как и легочная вентиляция у обоих космонавтов во время полета была несколько выше по сравнению с предполетными величинами. Увеличение ЧД является причиной установленного увеличения МОД, поскольку дыхательный объем (ДО) в покое в условиях невесомости не только не увеличился, но и уменьшился по сравнению с данными, полученными на Земле у командира экипажа (КЭ) на 17,2 %, у космонавта-исследователя (КИ) на 9,4 %. При работе на велоэргометре изменения ЧД у космонавтов носили противоположный характер. Так, у КЭ в полете ЧД при педалировании была выше, чем в предполетный период, а у КИ – ниже предполетных значений. Однако так же, как и в состоянии покоя, величина ДО при работе на велоэргометре у обоих космонавтов в невесомости была меньше величины ДО в условиях гравитации (у КЭ на 16,9 %, у КИ на 7,6 %). Некоторое уменьшение ДО при возрастании легочной вентиляции в период адаптации к невесомости требует объяснения. Возможной причиной этого факта является изменение эластического сопротивления легочной ткани вследствие увеличения ее кровенаполнения в невесомости. При этом для сохранения постоянства альвеолярной вентиляции энергетически более выгодным является учащение дыхания при некотором снижении дыхательного объема.
Определенный интерес представляют исследования параметров внешнего дыхания при проведении проб, направленных на уменьшение притока крови к верхней половине тела (ОДНТ и ИДН). Определение ЖЕЛ проводилось у всех четырех космонавтов (табл. 3, 4).
Исследования ЖЕЛ во время пробы ИДН показали, что при избыточном давлении +40 мм рт.ст. в наложенных на бедра манжетах ЖЕЛ несколько увеличивалась как в предполетный период, так и в полете у всех космонавтов.
При проведении пробы с ОДНТ изменения ЖЕЛ носили разнонаправленный характер. Теоретически функциональные пробы, направленные на уменьшение притока крови в верхнюю половину тела, должны в невесомости увеличивать ЖЕЛ. Расхождения в результатах, полученных при проведении пробы ИДН и ОДНТ, объясняются, по нашему мнению, способом и усилием фиксации на реберной дуге устройства для создания ОДНТ. При этом частично могут деформироваться грудная клетка и изменяться условия для проведения маневра, при котором определяется ЖЕЛ.
Таблица 3
Жизненная емкость легких у космонавтов при проведении пробы с ИДН
|
Космонавт |
Жизненная емкость легких, л |
|
до полета |
в полете |
|
фон |
Ризб. 40 мм рт.ст. |
фон |
Ризб. 40 мм рт.ст. |
|
КЭ-1 |
3,0 |
3,5 |
3,2 |
3,7 |
|
КИ-1 |
3,0 |
3,2 |
3,6 |
3,7 |
|
КЭ-2 |
4,0 |
4,4 |
3,7 |
3,9 |
|
КИ-2 |
4,4 |
5,0 |
- |
- |
Таблица 4
Жизненная емкость легких у космонавтов при проведении пробы с ОДНТ
|
Космонавт |
Жизненная емкость легких, л |
|
до полета |
в полете |
|
фон |
Р-40 мм рт.ст. |
фон |
Р-40 мм рт.ст. |
|
КЭ-1 |
3,25 |
3,5 |
3,5 |
3,5 |
|
КИ-1 |
3,5 |
3,3 |
2,55 |
2,7 (3-и сутки) |
|
КЭ-2 |
4,6 |
4,1 |
3,1 |
3,5 (5-е сутки) |
|
КИ-2 |
3,5 |
3,0 |
3,3 |
2,8 |
Концептуальный прогноз возможных функциональных изменений системы дыхания в процессе адаптации к невесомости, в частности изменений регуляции и биомеханики дыхания, диффузии газов, вентиляции и гемодинамики легких, газообмена, скоростно-силовых характеристик дыхательных мышц, респираторных изменений кислотно-основного состояния и газов крови получил убедительное подтверждение в дальнейших исследованиях в космических полетах российских и американских ученых.
В 1991 году во время 9-суточного полета орбитальной лаборатории SLS-1 Дж.Вест выполнил комплексные исследования респираторной системы с участием 4 астронавтов. В этом полете впервые был применен комплекс специализированной пульмонологической аппаратуры, обеспечивающей регистрацию и изучение таких сложных физиологических процессов, как влияние гравитации на региональное распределение вентиляции и перфузии в легких, равномерность внутрилегочного смешивания и вымывания индикаторных газов, интегральную диффузионную способность легких и ее компонентов: диффузионную способность альвеоло-капиллярной мембраны и объем крови в легочных капиллярах, формирование процесса экспираторного закрытия дыхательных путей, легочный газообмен и другие респираторные и гемодинамические функции легких.
В результате этих исследований получены уникальные данные, из которых особого внимания заслуживают следующие:
- В условиях микрогравитации наблюдается увеличение как интегральной диффузионной способности легких, так и ее компонентов. Авторы постулируют, что эти изменения являются следствием более равномерного, по сравнению с земной гравитацией, распределения легочной капиллярной крови по всем функциональным единицам легких от верхушек до основания. В результате более полного и равномерного рекрутирования легочных капилляров возрастает диффузионная способность альвеоло-капиллярной мембраны (Dm).
- Увеличение Dm, по мнению авторов, не подтверждает распространенную гипотезу о возможном развитии в условиях невесомости субклинической формы отека легких, во всяком случае после 9-суточного полета. Однако этот вывод достаточно полемичен и может быть подтвержден или опровергнут только прямым определением содержания воды в интерстициальной ткани легких.
- Наблюдавшиеся изменения гемодинамики в легких во время полета имели стабильный характер, что позволило сделать вывод об их преимущественно гравитационной природе, не подверженной адаптивным влияниям.
- Неравномерность региональной вентиляции легких, определенная по амплитуде кардиогенных осцилляций СО2, значительно (на 60 %) уменьшалась в невесомости, а так называемая 4-я фаза выдоха почти исчезала, что свидетельствует о равномерном распределении легочного кровотока по всей площади диффузии альвеоло-капиллярной мембраны.
Таким образом, результаты исследований, выполненных по время краткосрочной 9-суточной миссии на SLS-1, следует рассматривать как значительный вклад в нормальную и гравитационную физиологию легких на этапе адаптации к невесомости. Однако функциональные изменения внешнего дыхания и легких, как показывает опыт многолетних исследований, выполненных в ИМБП, наиболее вероятны через 110–120 суток полета. Результаты таких исследований, выполненных с участием 23 космонавтов по программе до- и послеполетных КФО, показали, что кратковременные (до 10 суток) и средней продолжительности (до 65 суток) космические полеты не вызывают существенных изменений показателей внешнего дыхания, в то время как после длительных полетов (113–366 суток) наблюдали достоверное уменьшение статических и динамических объемов легких и изменения объемно-скоростных параметров форсированных дыхательных маневров.
Следует также иметь в виду то обстоятельство, что отмеченные изменения собственных физиологических характеристик легких могут иметь негативное влияние не только на респираторную систему, но и на физическое состояние космонавта в целом, в частности, на его физическую работоспособность.
Хорошо известный феномен снижения физической работоспособности космонавтов после длительного пребывания в невесомости обычно интерпретируют как результат детренированности сердечно-сосудистой системы и антигравитационной скелетной мускулатуры вследствие длительного отсутствия гравитационной нагрузки. Вместе с тем, в нашей лаборатории в последние годы разрабатывается гипотеза, предполагающая, что в процесс детренированности вовлекаются не только скелетные, но и дыхательные мышцы, в результате чего они оказываются не в состоянии обеспечивать адекватный предъявляемой физической нагрузке объем вентиляции легких, что может проявляться относительной гиповентиляцией, альвеолярной и артериальной гиперкапнией, накоплением недоокисленных продуктов метаболизма, снижением Ph и ограничением аэробной производительности. Таким образом детренированность дыхательных мышц может играть определенную роль в формировании феномена послеполетного снижения физической работоспособности космонавтов. Эта гипотеза основана на ряде теоретических предпосылок, результатах модельных исследований и клинико-физиологических обследований космонавтов. Однако она нуждается в дальнейшем углублении на основе исследований в длительных и сверхдлительных полетах.
Такие исследования были проведены с участием экипажа ЭО-17 станции «Мир». Причем первое исследование параметров форсированных вдохов и выдохов у КИ (П.В.В.) на борту ОС было проведено спустя 13 месяцев после предполетного обследования, т.е. в условиях стойкой адаптации к невесомости. В результате было установлено, что по сравнению с исходными данными, а они были очень высокими и превышали должные значения на 20–25 %, что свидетельствовало о хорошей физической форме П.В.В., после одного года пребывания в невесомости наметилась четкая тенденция к снижению ряда показателей.
В частности, ЖЕЛ уменьшалась с 5,31 до 4,67 л (на 13 %), форсированная ЖЕЛ уменьшалась на 16 %. Отчетливо и стойко (со 156 до 74 % от должной величины) уменьшался резервный объем выдоха. Эти изменения легочных объемов связаны с изменениями конфигурации грудной клетки, живота и положения диафрагмы в результате их эластической деформации в условиях отсутствия силы тяжести.
Объемно-скоростные показатели форсированного выдоха существенно не изменялись, что указывает на сохранение нормальной бронхиальной проходимости и сопротивления дыхательных путей.
Вместе с тем, следует отметить снижение пиковых объемных скоростей выдоха и особенно вдоха (на 15–20 %), а также уменьшение максимальной произвольной вентиляции легких на 20–30 %, что свидетельствует о снижении скоростно-силовых характеристик дыхательных мышц.
Увеличение минутного объема вентиляции легких (МОД увеличивался почти вдвое за счет увеличения дыхательного объема) с биоэнергетической точки зрения можно объяснить использованием тренировочно-нагрузочного костюма «Пингвин», в котором проводились исследования функции внешнего дыхания. Другой интерпретацией этого феномена могут быть так называемые юкстакапиллярные рефлексы, вызываемые гиперволемией и гипергидратацией легких.
Вместе с тем, следует особо подчеркнуть достаточно быструю обратимость наблюдавшихся изменений легочных объемов, связанных, в основном, с отсутствием гравитации. Через 5 суток после полета все исследованные объемы практически возвратились к исходным значениям, однако восстановление скоростных параметров, связанных с мышечными усилиями, произошло не полностью. Пиковая скорость вдоха полностью не восстановилась и спустя полгода.
Следует также заметить, что при сверхдлительных полетах порядка 1,5–2 года необходимо учитывать влияние на ту или иную функциональную систему организма не только факторов космического полета, но и динамику биологического старения. В частности, некоторые параметры внешнего дыхания могут регрессировать за 1,5 года приблизительно на 1 %.
У БИ ЭО 17 изменения респираторных параметров имели достаточно четкую рестриктивную тенденцию, в результате чего ЖЕЛ уменьшалась на 13–17 % и приближалась к нижней границе нормальных должных значений. При этом рестриктивная тенденция сопровождалась обструктивной, в результате которой отмечено уменьшение максимальной скорости потока выдоха на уровне 50–75 % ЖЕЛ. Показатели, характеризующие функциональное состояние дыхательных мышц – пиковая скорость вдоха и произвольная максимальная вентиляция легких, уменьшались на 10–12 %.
Таким образом, тенденция изменений респираторных показателей во время полета у обоих космонавтов была приблизительно одинакова и может быть интерпретирована как результат изменений конфигурации грудной клетки, живота и положения диафрагмы, а также увеличенным кровенаполнением легких и уменьшением скоростно-силовых возможностей дыхательных мышц.
Поэтому несмотря на то, что гипотеза о возможной роли дыхательных мышц в формировании феномена снижения физической работоспособности нуждается в дальнейшем исследовании и подтверждении, полученные данные позволяют ставить вопрос о необходимости создания специальных средств и методов тренировки дыхательных мышц в длительных полетах для поддержания физической работоспособности космонавтов.
Через 13 месяцев после окончания полета основные респираторные показатели соответствовали должным значениям и даже несколько превышали их, в то же время объемные показатели были меньше предполетных значений на 8–10 %, скоростные на 15–20 %, сопротивление дыхательных путей не изменялось. Отмеченная динамика связана, по-видимому, со снижением физической активности по сравнению с предполетным периодом.
Помимо исследования характера изменений внешнего дыхания в невесомости врачом-космонавтом В.В.Поляковым был проведен эксперимент по определению напряжения кислорода в артериализованной крови (РаО2) во время космического полета 4-й основной экспедиции на орбитальную станцию «Мир» (Haase, Baranov et al., 1990). РаО2 измеряли при помощи прибора КП-01, разработанного специалистами ГДР в рамках программы «Интеркосмос», за 30 суток до полета, на 83-и, 160-, 165-, 171-е и 180-е сутки пребывания космонавтов на орбите и через 22 ч после приземления.
Исследования показали, что значения РаО2 в предполетный период соответствуют должным значениям. Во время космического полета отмечаются более низкие (на 12–30 %) величины напряжения кислорода в артериализованной крови по сравнению с предполетными, несмотря на несколько более высокое содержание кислорода в атмосфере ОС. При этом проба с ОДНТ в полете усиливала это снижение (на 18 % по сравнению с фоном и на 36 % по сравнению с предполетной величиной). В первые сутки после окончания полета у 2 космонавтов значения РаО2 оставались все еще ниже предполетных значений на 17–23 %, а у третьего превышали их на 8 %. Активная ортостатическая проба, выполненная в 1-е сутки реадаптационного периода у космонавта-исследователя, вызывала повышение напряжения кислорода в крови по сравнению с горизонтальным положением, что возможно связано с наблюдавшейся гипервентиляцией.
Установленное снижение РаО2 можно рассматривать как признак определенных изменений кислородного режима организма во время длительных космических полетов.
Причины указанных изменений, на наш взгляд, могут заключаться в нарушении вентиляционно-перфузионных отношений вследствие гиперволемии легких в невесомости и исчезновении градиента гидростатического давления между основанием и верхушками легких, а также в нарушении соотношения диффузия–кровоток, отчасти в связи с действием уже упомянутых факторов, отчасти из-за возможных отечных изменений интерстиция. Уточнить механизмы происходящих изменений можно проведя исследования в невесомости с радиоактивными изотопами.
3.Модельные исследования по уточнению механизмов изменений респираторной системы в невесомости
3.1.Влияние антиортостатической гипокинезии на
функциональное состояние дыхательных мышц
Основные задачи исследования состояли в оценке функционального состояния диафрагмы как основной инспираторной мышцы и реакций респираторной системы в целом на функциональные нагрузки после антиортостатической гипокинезии (АНОГ). В качестве нагрузок использовали ортостатическую пробу и конечно-экспираторную окклюзию дыхательных путей. Исследование выполнено на 16 лабораторных крысах линии Вистар, разделенных на две группы: контрольную и экспериментальную. Контрольная группа животных (n = 8) содержалась в обычных условиях, экспериментальная группа (n = 8) в течение 3 недель находилась в условиях АНОГ.
После 3 недель пребывания в вывешенном состоянии экспериментальные животные, так же, как и животные контрольной группы, наркотизировались внутрибрюшинным введением уретана из расчета 1000 мг/кг и тестировались в условиях острого эксперимента. Для проведения эксперимента животные закреплялись в положении лежа на спине на специальном станке, угол наклона которого можно было изменять.
Экспериментальных крыс снимали со стенда, не изменяя угла наклона туловища; находясь во время хирургических процедур в положении АНОГ -ЗОo, они переводились в ортостатическое положение +75°, а через 10 минут – в горизонтальное. Контрольные животные подвергались постуральным воздействиям по той же схеме.
Во всех положениях тела производилась регистрация объемно-временных параметров дыхания, внутригрудного (пищеводного) и гастрального давления, электрической активности диафрагмы (ЭМГ). Для регистрации частоты дыхания (f) и величины дыхательного объема (Vт) крысам через трахеостому вводили в трахею миниатюрную пневмотахографическую трубку.
Силу сокращений дыхательных мышц оценивали по величине инспираторных колебаний гастрального (Рд) и пищеводного (P3) давлений (Agostoni, Rahn, 1960; Milik-Emili et al., 1964). Для измерения максимальной силы сокращений дыхательных мышц производили конечно-экспираторную окклюзию дыхательных путей. Максимальная сила сокращений диафрагмы оценивалась по величине гастрального давления (Рд max), развиваемого в первом окклюзионном вдохе. Более продолжительная окклюзия (до пяти окклюзионных вдохов) позволяла оценить реакцию дыхательных мышц на хеморецепторную стимуляцию дыхания, которая усиливается по мере удлинения окклюзии.
Количественная оценка ЭМГ диафрагмы производилась по пиковой величине интегрированного электрического сигнала (Edi). Показано, что именно этот параметр наиболее точно коррелирует с уровнем возбудимости дыхательного центра и другими параметрами вентиляции (Eldridge, 1971, 1976; Fitzgerald, 1973; Evanich et al., 1976).
Регистрация объемно-временных параметров дыхания показала, что у животных экспериментальной группы, находящихся в течение 3 недель в состоянии АНОГ, наблюдалось достоверное уменьшение минутной вентиляции легких по сравнению с контрольной группой (табл. 5).
Таблица 5
Объемно-временные параметры внешнего дыхания у наркотизированных крыс
в контрольной и экспериментальной группе
|
Параметры |
Контрольная группа |
Экспериментальная группа |
|
горизонт |
АОП (-30o) |
ОП (+75o) |
горизонт |
АОП(-30o) |
ОП(+75o) |
|
Vт, мл |
1,7 ± 0,3 |
1,4 ±
0,2 |
1,5 ± 0,2 |
1,2 ± 0,2 |
1,1 ± 0,1 |
1,0 ± 0,1 |
|
F, дых/мин |
98 ± 5 |
96 ± 4 |
93 ± 6 |
92 ± 5 |
92 ± 4 |
90 ± 6 |
|
VE, мл/мин |
178,6 ± 26,8 |
153,6 ± 23,8 |
154,2 ± 24,1 |
104,3 ± 9,7* |
96,0 ± 7,3* |
83,6 ± 3,7 |
VT – дыхательный объем, f – частота дыхания, VЕ– минутный объем дыхания.
*достоверные отличия от контрольной группы (p <0,05).
Изменялась и вентиляторная реакция на ортостатическую пробу. Так, перевод экспериментальных животных из антиортостатического (АОП) в ортостатическое положение (ОП) снижал минутный объем дыхания в среднем на 13 %, тогда как в контрольной группе животных ортостатическая проба, примененная после 10 мин пребывания в АОП, не влияла на уровень вентиляции легких. Эти факты указывают на то, что АНОГ влияет на функцию внешнего дыхания, вызывая снижение фонового уровня вентиляции легких и развитие ортостатической неустойчивости вентиляторной системы.
Анализируя механизмы респираторных эффектов АНОГ логично предположить, что уменьшение МОД, обнаруженное у животных экспериментальной группы, могло быть связано с раздражением барорецепторов сосудистых рефлексогенных зон вследствие увеличения кровенаполнения сосудистой системы головы и органов грудной полости при переходе в АОП и тем более при длительном нахождении в этом положении. Известно, что усиление импульсации от сосудистых барорецепторов приводит к торможению как инспираторных, так и экспираторных нейронов дыхательного центра. В результате уменьшаются как частота, так и глубина дыхания, а соответственно и минутный объем дыхания. Однако если бы основной причиной снижения вентиляции легких у экспериментальных животных действительно являлось усиление афферентации от сосудистых рефлексогенных зон, то возврат животного из АОП в горизонтальное положение должен был восстановить вентиляцию легких до исходного уровня. Между тем, и в горизонтальном положении МОД у экспериментальных животных был достоверно ниже, чем у животных контрольной группы. Величина минутной вентиляции легких не достигала контрольных значений даже через 60 минут пребывания в обычном горизонтальном положении. Кроме того, как в контрольной, так и в экспериментальной группе животных не обнаружено срочных вентиляторных реакций при переводе животных из горизонтального положения в АОП и наоборот. Сразу после перехода в АОП наблюдалась лишь небольшая тенденция к снижению уровня вентиляции. Таким образом, анализ полученных фактов указывает на то, что наблюдаемые респираторные эффекты связаны с длительным действием АНОГ и не могут быть в полной мере объяснены только барорефлекторными механизмами регуляции дыхания.
Для выявления механизмов влияния длительно действующей АНОГ на состояние системы внешнего дыхания необходимо проанализировать изменения функционального состояния дыхательной мускулатуры, так как перераспределение крови в верхнюю половину тела вызывает существенное увеличение нагрузки на дыхательные мышцы. Этому способствует рост эластического и резистивного компонента сопротивления дыханию. Возрастание эластического сопротивления связано с увеличением кровенаполнения легких, характерным для АОП, и уменьшением вследствие этого их растяжимости (Дьяченко, Шабельников, 1985). Значительному увеличению резистивного сопротивления могут способствовать гиперемия и отек слизистой верхних дыхательных путей, что приводит к ухудшению их проходимости. Рост эластического и резистивного сопротивления увеличивает механическую нагрузку на дыхательные мышцы, длительное действие которой способствует развитию диафрагмального утомления (Александрова, Исаев, 1990).
В нашем исследовании на ухудшение функционального состояния диафрагмы после длительного действия АНОГ указывала динамика гастрального давления (Pg). Величина инспираторных колебаний Pg может использоваться как показатель силы диафрагмальных сокращений, так как они генерируются сокращениями только диафрагмы, в отличие от инспираторных колебаний пищеводного (плеврального) давления, отражающих суммарную силу сокращений всей инспираторной мускулатуры (диафрагмы, наружных межреберных и парастернальных, вспомогательных мышц). Динамика Pg хорошо коррелирует с динамикой трансдиафрагмального давления и применяется для диагностики диафрагмального утомления (Aldrich, Appel, 1985). Проведенные нами эксперименты показали, что максимальная величина инспираторных колебаний Pg (регистрируемая в момент окклюзионного вдоха) у животных экспериментальной группы достоверно ниже, чем у животных контрольной группы (рис. 2). Этот факт указывает на то, что длительная АНОГ вызывает снижение максимальной силы сокращений диафрагмы, и, следовательно, уменьшение функционального резерва мощности системы внешнего дыхания.
Ухудшение сократительной способности диафрагмы подтверждалось и характерными различиями реакций животных контрольной и экспериментальной групп на конечно-экспираторную окклюзию дыхательных путей (рис. 2). Конечно-экспираторная окклюзия устраняет тормозный афферентный поток, поступающий в дыхательный центр от механорецепторов легких, так как окклюзионные вдохи осуществляются на уровне функциональной остаточной емкости без изменения объема легких (Richardson et al., 1973). В то же время при окклюзии происходит усиление активирующих хеморецепторных влияний. В результате стандартной реакцией на окклюзию является увеличение силы сокращений всех инспираторных мышц, в том числе и диафрагмы, что и наблюдалось у контрольной группы животных: происходило одновременное увеличение инспираторных колебаний и пищеводного, и гастрального давления.
Рис. 2. Реакция на конечно-диастолическую окклюзию у животных контрольной (А) и экспериментальной (Б) группы. Edi – ЭМГ диафрагмы (интегрированная кривая), Pg, Pes – инспираторные колебания гастрального и пищеводного давлений. V – пневмотахограмма.
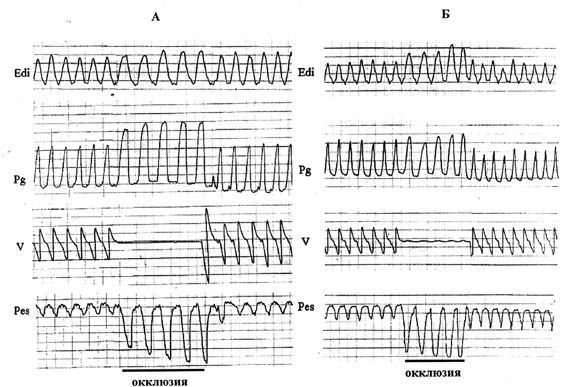
В отличие от этого, у животных экспериментальной группы при окклюзии значительно увеличивалось только пищеводное давление, т.е. суммарная сила сокращений всей инспираторной мускулатуры, тогда как гастральное давление, инспираторные колебания которого генерируются сокращениями только диафрагмы, очень слабо реагировало на окклюзию: амплитуда инспираторных колебаний Pg либо вообще не возрастала, либо ее увеличение было значительно меньше, чем у животных контрольной группы. Полученные данные позволяют сделать вывод об ослаблении сократительного ответа диафрагмы на механо- и хеморецепторную стимуляцию после длительного действия АНОГ. Причем, уменьшение ответа на окклюзию, также как и снижение максимальной силы сокращений диафрагмы у экспериментальных животных наблюдалось в любом пространственном положении (АОП, ОП, горизонтальное положение), т.е. не зависело от биомеханических условий осуществления вдоха и интенсивности стимуляции сосудистых барорецепторов.
Ослабление диафрагмальных сокращений, вызванное действием АНОГ, в определенной степени могло быть связано с уменьшением эфферентной активации диафрагмы вследствие ослабления центральной инспираторной активности под действием гипокинезии.
Рис. 3. Ухудшение сократительной способности диафрагмы в ортостатическом положении после 3-ндельной антиортостатической гипокинезии. По оси ординат: пиковая величина
интегрированной активности диафрагмы (Edi) и максимальное гастральное давление (Pg max)
в первом окклюзионном вдохе, выраженные в процентах по отношению к их средним
величинам при спокойном дыхании; белые столбики – экспериментальная группа животных;
черные столбики – контрольная группа
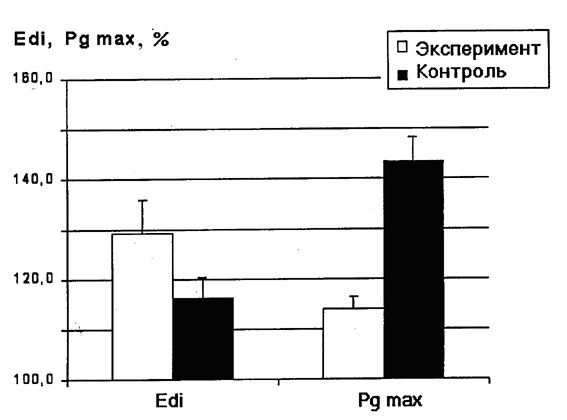
Известно, что электрическое раздражение афферентных волокон, иннервирующих мышцы, пассивное движение конечностей или просто сжатие мышцы вызывает повышение центральной инспираторной активности (Eldridge et al., 1982; Wasserman et al., 1986). Поэтому гипокинезия может вызвать противоположный эффект – снижение центральной инспираторной активности, т.к. в этих условиях устраняется или по крайней мере, ослабевает активирующий афферентный поток, поступающий в дыхательный центр от мышечных проприорецепторов. Однако в условиях нашего исследования этот механизм, по-видимому, не являлся определяющим, т.к. было обнаружено, что в экспериментальной группе животных степень усиления ЭМГ диафрагмы при окклюзии не ниже, а в некоторых случаях даже выше, чем в контрольной группе. Так, например, в ортостатическом положении у экспериментальных животных ЭМГ диафрагмы в первом окклюзионном вдохе увеличивалась на 30 % (129 ± 6 %), а у контрольных животных только на 16% (116 ± 2 %). Тем не менее, прирост силы диафрагмальных сокращений в экспериментальной группе был значительно ниже и составил всего 14 % (114 ± 4 %), тогда как в контрольной – 43 % (143 ± 4 %) (рис. 3).
Таким образом, меньший прирост силы сокращений диафрагмы, обнаруженный в экспериментальной группе, не был связан с более слабой эфферентной активацией диафрагмы, которая отражает уровень центральной инспираторной активности, а, следовательно, определялся причинами периферического характера. По всей вероятности, развивалось так называемое сократительное утомление, при котором страдает лишь процесс сокращения мышечного волокна, тогда как его способность к возбуждению остается на прежнем уровне (Edwards, 1978; Braun, 1984). По мере развития утомления такого типа для генерации той же самой силы сокращения требуется все больший уровень электрической активности мышцы, что и было обнаружено при сравнении электрической активности диафрагмы и соответствующей ей силы сокращений у контрольных и экспериментальных животных. В экспериментальной группе животных для генерации даже меньшего по силе диафрагмального сокращения, чем в контрольной группе, требовался гораздо больший уровень активации мышечных волокон. Об этом свидетельствуют и проведенные расчеты, которые показали, что у экспериментальных животных при одной и той же степени эфферентной активации диафрагмы генерируется меньшее по силе диафрагмальное сокращение, чем у животных контрольной группы. Так, в экспериментальной группе животных увеличение электрической активности диафрагмы на 10 % вызывало увеличение Pg в фазу инспирации (т.е. силы сокращений диафрагмы) в среднем всего на 5 % вне зависимости от положения тела, тогда как в контрольной группе животных это увеличение составляло не менее 12 %: 13 ± 3 % в антиортостатическом, 12 ± 2 % в горизонтальном положении и 26 ± 2 % в ортостатическом положении (рис. 4).
Рис. 4. Прирост силы сокращений диафрагмы при увеличении ее электрической активности на 10 % у животных экспериментальной группы (белые столбики) и контрольной (черные столбики) групп. По оси ординат – прирост Pg , выраженный в процентах; АОП – антиортостатическое, горизонт – горизонтальное, ОП – ортостатическое положение
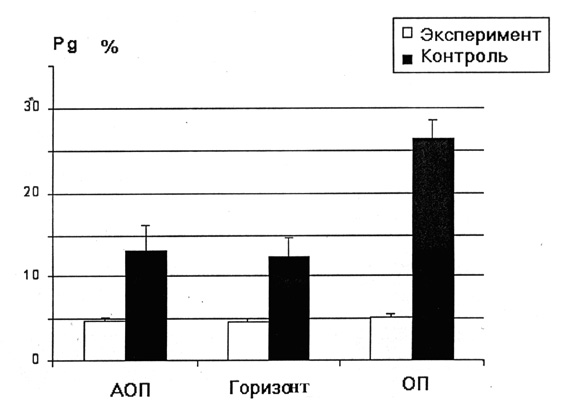
Развитие сократительного утомления диафрагмы уже демонстрировалось в исследованиях, которые проводились не только на животных (Aubier et al., 1981), но и на человеке (Muller et al., 1979; Aubier et al., 1984). Предполагается, что основным механизмом развития этого типа утомления является метаболический ацидоз, вызывающий нарушение связи между процессами возбуждения и сокращения в мышечных волокнах диафрагмы. Снижение внутриклеточного рН замедляет процесс высвобождения Са+2 из саркоплазматического ретикулума при возбуждении мышечного волокна, что приводит к уменьшению количества взаимодействий между актиновыми и миозиновыми нитями и, как следствие, к падению силы мышечного сокращения (Nakamura et al., 1972; Smith-Blair, 2002). При высоких рабочих нагрузках основной причиной накопления в дыхательных мышцах молочной кислоты, вызывающей развитие метаболического ацидоза, является переход мышцы на анаэробный путь обмена вследствие перерасхода и истощения энергетических ресурсов. В условиях гипокинезии метаболическому ацидозу способствуют еще и нарушения углеводного обмена, который переключается на анаэробное окисление – гликолиз, сопровождающийся накоплением в мышечных клетках кислых продуктов обмена (Федоров, 1980). Кроме того при гипокинезии наблюдается уменьшение содержания в тканях основного энергетического субстрата – гликогена (Федоров, 1980), недостаток которого также предрасполагает к развитию мышечного утомления (Bergstrom et al., 1967).
Сократительное утомление может быть связано также и со структурными повреждениями (Edwards et al., 1981; Jones, 1981) или с изменениями эластических свойств утомленных мышц (Vigreux et al., 1980). Гистологические исследования скелетных мышц и миокарда показали, что гипокинезия вызывает изменение структуры мышечной ткани, особенно скелетной мускулатуры, в виде ее склерозирования. Причем в наибольшей степени страдают медленные мышечные волокна (Шенкман и др., 2000; Ильина-Какуева, 2001), т.е. волокна, наиболее устойчивые к утомлению. Отмечается уменьшение васкуляризации и признаки замещения мышечных волокон соединительно ткаными элементами. Значительное увеличение содержание коллагена отмечается не только в скелетных мышцах, но и в миокарде. Эти изменения могут отрицательно влиять на сократительную способность мышц, особенно в реабилитационный период после длительной гипокинезии. К сожалению, дыхательные мышцы в этом плане почти не исследованы. Однако весьма вероятно, что подобные изменения могут происходить и в дыхательных мышцах, которые являются поперечно-полосатыми и по своей структуре качественно не отличаются от другой скелетной мускулатуры.
Итак, результаты нашего исследования указывают на то, что антиортостатическая гипокинезия вызывает уменьшение минутной вентиляции легких при спокойном дыхании, развитие ортостатической неустойчивости и снижение функционального резерва мощности системы внешнего дыхания. Основным механизмом обнаруженных респираторных эффектов АНОГ является функциональная недостаточность диафрагмы, вызванная ухудшением ее сократительной способности и нарушением связи между процессами возбуждения и сокращения в мышечных волокнах диафрагмы.
3.2.Влияние изменений внутригрудного и центрального венозного
давления на динамику наполнения сердца
Известно, что изменения биомеханики дыхания, вызванные коррекцией транспульмонального или трансторакального давления (водная иммерсия; дыхание под отрицательным давлением; разные виды искусственной вентиляции легких; профилактика затруднений дыхания при профессиональной деятельности человека в экстремальных условиях: глубоководные погружения, гравитационные перегрузки, аварийные ситуации в условиях высотного полета и др.) оказывают существенное влияние на внутригрудную гемодинамику и приводят к изменениям венозного возврата, давления наполнения сердца и сердечного выброса. При спонтанном дыхании циклический характер давления наполнения правого сердца, в первую очередь, обусловлен колебаниями соотношений внутригрудного давления (ВГД) и центрального венозного давления (ЦВД), связанных со сменой дыхательных фаз. В условиях постоянного положительного или отрицательного давления в грудной полости трансформация соотношений физических параметров (эластичность, сопротивление, внутреннее напряжение тканевых структур), определяющих биомеханику дыхания и внутригрудную гемодинамику, может являться фактором, формирующим изменение давления наполнения сердца.
Целью исследования явилось выяснение зависимости трансмурального давления в правом предсердии от соотношений ВГД и ЦВД в ходе дыхательного цикла в условиях дыхания с положительным и отрицательным давлением.
В 1956 году Henry, Gauer, раздувая баллончик в правом предсердии собаки, наблюдали увеличение диуреза и натрийуреза, которые происходят за счет подавления экскреции антидиуретического гормона. Эта реакция, в последующем названная рефлексом Генри – Гауэра, легла в основу рабочей гипотезы, согласно которой перераспределение крови в краниальном направлении увеличивает венозный возврат и центральное венозное давление, иначе говоря, увеличивает давление наполнения сердца, давление растяжения, в результате чего происходит растяжение камер сердца, что инициирует разгрузочные сердечно-сосудистые и нейрогуморальные рефлексы, приводящие к увеличению сердечного выброса, к увеличению экскреции почками жидкости и электролитов, к уменьшению объема плазмы и циркулирующей крови.
Однако в 1975 году Goetz высказал предположение о том, что в регуляции экскреции аргинин-вазопрессина участвуют не только кардиопульмональные рецепторы, т.е. рецепторы низкого давления, но и артериальные барорецепторы высокого давления (аортальные и синокаротидные), реагирующие преимущественно на изменения пульсового артериального давления.
Отсюда напрашивалось другое предположение, что гипотеза о ренальных и сердечно-сосудистых реакциях в космическом полете по Генри–Гауэру излишне упрощена и нуждается в уточнении и расширении. И это предположение подтвердилось в исследованиях, проведенных в последние 20 лет в реальных полетах. В частности, Kirsch (1984) впервые, вопреки ожиданиям, наблюдал у астронавта снижение давления в кубитальной вене, расположенной на уровне сердца, вместо его увеличения. Затем были получены такие же результаты, т.е. снижение центрального венозного давления, измеренного косвенным методом Дюрра, и, наконец, методом прямого инвазивного измерения ЦВД при катетеризации верхней полой вены и правого предсердия у астронавтов в полетах на Шаттле. Buckey, Gaffney, Blomqvist (1996) провели такие исследования на SLS-1 и SLS-2 у 3 астронавтов. В результате было установлено, что среднее ЦВД до полета в положении сидя составляло у них 8,4 см вод.ст., а через 10 мин пребывания в невесомости ЦВД снижалось до 2,5 см вод.ст.
Пожалуй, наиболее полно документирована методика и результаты катетеризации верхней полой вены у астронавта в исследовании, проведенном на борту орбитальной лаборатории D-2 Norsk в 1996 году. По данным авторов, в исходном положении на Земле ЦВД колебалось в пределах 6,5–5,2 мм рт.ст., увеличивалось во время пика перегрузок до 17 мм рт. ст. и резко снижалось в момент наступления невесомости до предполетного уровня и даже ниже, до 2,0 мм рт.ст.
Таким образом, феномен снижения ЦВД в невесомости, вместо ожидаемого его увеличения, можно считать установленным достаточно достоверно.
Именно с феноменом снижения ЦВД в невесомости связан второй неожиданный физиологический феномен: если ЦВД действительно снижается, то должно уменьшаться наполнение сердца и, следовательно, должен уменьшиться сердечный выброс. Однако этого не происходит. По данным многих отечественных и зарубежных исследований, выполненных с применением различных методик: ультразвуковых, импедансных, газовых и др., установлено, что в первые часы и дни пребывания в невесомости ударный и минутный объем сердца не уменьшается, а даже увеличивается на 15–20 % (Bungo, 1986).
Следовательно, возникает физиологический парадокс: ЦВД или давление наполнения сердца уменьшается, а сердечный выброс увеличивается. Для объяснения этого парадокса предложены две гипотезы, основанные на совершенно различных физиологических механизмах и заслуживающих поэтому сравнительного обсуждения.
Первая гипотеза предложена Norsk с соавт., вторая – Convertino с соавт. Гипотеза Norsk основана на предположении, что в условиях невесомости внутригрудное давление уменьшается в большей степени, чем венозное, а поскольку истинное трансмуральное центральное венозное давление представляет собой алгебраическую сумму двух давлений: положительного Pv и отрицательного (-Ppl), т.е. CVPtm = Pv - (-Ppl), то при снижении внутригрудного давления CVPtm должно увеличиться. Однако причины этого феномена авторами гипотезы не раскрываются.
Тем не менее, предположительную интерпретацию этого феномена можно допустить, основываясь на данных из области биомеханики дыхания: снижение внутригрудного давления возможно только в одном случае – если конфигурация грудной клетки изменится в инспираторную позицию. Прямых доказательств таких изменений в невесомости нет, хотя эти расчеты в 1998 году подтвердили White and Blomqist на механической модели легких и грудной клетки: в условиях невесомости грудная клетка релаксируется, с нее снимается вес плечевого пояса и органов брюшной полости и ее объем увеличивается.
Однако косвенные данные по исследованиям грудо-брюшной механики в невесомости, полученные Paiva (1989) в параболических полетах, не подтверждают возможность таких изменений. Им установлено, в частности, уменьшение функциональной остаточной емкости легких и увеличение растяжимости передней брюшной стенки, что приводит к уменьшению отрицательности внутриплеврального и трансторакального давлений.
Поэтому в целом этот вопрос и гипотезу Norsk нельзя считать решенными, они нуждаются в специальном дальнейшем изучении.
Вторая гипотеза интерпретации космического парадокса (увеличения сердечного выброса при уменьшении давления наполнения сердца) предложена Convertino (1998) и состоит в том, что в условиях невесомости изменяются биомеханические характеристики самого сердца, сердечной мышцы, в частности, увеличивается ее растяжимость (compliance) (AV/AP), в результате чего конечно-диастолический объем желудочков сердца и соответственно сердечный выброс увеличиваются, несмотря на уменьшение давления наполнения сердца, т.е. ЦВД.
Этот феномен получил достаточно четкое подтверждение в экспериментах на приматах, проведенных в ИМБП в условиях антиортостатической гипокинезии. Однако природа изменения compliance остается неясной: в качестве возможной причины рассматриваются изменения симпатического тонуса.
Таким образом, природа парадоксального феномена поведения ЦВД и сердечного выброса в космическом полете не ясна как в интерпретации Convertino с соавт., так и Norsk с соавт. Поэтому физиологические механизмы этого парадокса представляют собой новое и обширное поле для будущих исследований. Помимо теоретического значения эти исследования позволят совершенствовать средства и методы профилактики неблагоприятных последствий регионального перераспределения крови в невесомости.
На одном из таких методов, над которым работала наша лаборатория, я хотел бы остановиться:
Существующие в настоящее время штатные физические средства коррекции гемодинамических сдвигов в невесомости (компрессионные манжеты и ОДНТ), несмотря на их различные физические механизмы и регионы применения, имеют единый физиологический механизм, основанный на депонировании части объема циркулирующей крови в периферическом сосудистом русле туловища, в частности нижних конечностей, вызывающем ограничение венозного возврата к сердцу с последующим уменьшением кровенаполнения головы и торако-абдоминальных органов.
Вместе с тем, теоретически существует принципиально иной механизм снижения увеличенного кровенаполнения головы, основанный не на ограничении притока, а на усилении оттока крови из интракраниальных сосудов по яремным венам в грудную полость, в верхнюю полую вену и камеры сердца.
Этот механизм может быть реализован посредством создания отрицательного внутригрудного давления или точнее, посредством усиления его отрицательности путем дыхания через лицевую маску из ресивера, в котором создается дозированное разрежение.
В идеале величина этого разрежения, а если точнее, то величина создаваемого отрицательного внутригрудного давления, должна быть равна приросту гидростатического давления в сосудах черепа, вызванного наклоном тела, чтобы компенсировать гидростатический прирост и обеспечить нормальный отток крови из венозной системы головы.
При антиортостатической модели невесомости -6° отрицательное внутригрудное давление, эквивалентное приросту гидростатического давления и рассчитанное по синусу угла наклона, должно составлять около -15 см вод.ст.
Эта величина сопоставима со средней величиной отрицательного внутригрудного (трансторакального) давления, возникающего при водной иммерсии в горизонтальном положении тела (около -10 см вод.ст.) и значительно меньше отрицательного гидростатического давления в «центре легких» (-20 см вод.ст.) при вертикальной иммерсии до уровня шеи.
Поэтому, кроме усиления оттока крови из головы, некоторое увеличение притока крови в грудную полость, теоретически ожидаемое при дыхании под отрицательным давлением (ДОД), не должно превышать притока крови, возникающего в невесомости, и следовательно, не может лимитировать применения ДОД как метода профилактики, т.к. известно, что многосуточное пребывание в горизонтальной и даже в вертикальной иммерсии не вызывает каких-либо существенных негативных гемодинамических и кардиореспираторных реакций.
Следует учитывать также существование целого ряда физиологических механизмов предотвращения внутригрудной гиперволемии, в частности, способность саморегуляции деятельности сердца по закону Франка – Старлинга, т.е. увеличение выброса крови в ответ на увеличение объема наполнения камер сердца.
Кроме того дыхание под отрицательным давлением вызывает увеличение трансмурального давления во внутригрудных сосудах и тем самым стимулирует внутригрудные барорецепторы, преимущественно низкого давления, кардиопульмональные барорецепторы, стимуляция которых запускает цепочку разгрузочных нейрогуморальных рефлексов типа рефлекса Генри – Гауэра (Ларина, Китаева и др.). По-видимому, благодаря этим разгрузочным рефлексам кровенаполнение легких в условиях микрогравитации не достигает функционально значимых величин, во всяком случае, основной вывод исследований West и соавт., выполненных на SLS-1, состоит в том, что поскольку диффузионная способность альвеоло-капиллярной мембраны в 9-суточном полете не изменялась, нет оснований предполагать вероятность возникновения гипергидратации или, тем более, предотечного состояния легких.
В наших исследованиях, проведенных с участием 5 мужчин, изучалась возможность конвертирования с помощью ДОД гемодинамических пока-зателей головы человека, находящегося в антиортостатическом положении, в показатели, характерные для горизонтальной позы.
В результате психометрического шкалирования по Боргу установлено, что ДОД -10....-15 см вод.ст. полностью или частично снимало вызванные наклоном тела дискомфортные ощущения увеличенного кровенаполнения головы. При биоимпедансных исследованиях установлено уменьшение реографических показателей пульсового кровенаполнения головы и усиление венозного оттока из сосудистой системы головы. При ультразвуковой эхолокации головного мозга установлено расширение бокового желудочка мозга, что указывает на уменьшение объема крови в полости черепа и замещение ее цереброспинальным ликвором.
При допплеровской церебро-цервикальной вазографии установлено отчетливое уменьшение площади поперечного сечения югулярных вен и резкое усиление скорости венозного оттока.
Полученные результаты позволяют заключить, что дыхание под отрицательным давлением может рассматриваться как эффективный способ коррекции кровообращения головы при антиортостатическом моделировании физиологических эффектов невесомости.
Этот вывод подтверждают также результаты инвазивных исследований на животных, выполненных по нашей просьбе в лаборатории физиологии дыхания Института физиологии им. Павлова.
Рис. 5. Влияние дыхания под отрицательным давлением (ДОД) на гемодинамику у кошки
1 – ЭКГ; 2 – давление в трахее; 3 – внутригрудное давление; 4 – АД; 5 – давление
в верхней полой вене; 6 – давление в нижней яремной вене
На рис. 5 видно, что у кошки при переводе в АОП -30° давления внутригрудное (в пищеводе), в верхней полой вене и в яремной вене увеличиваются и отчетливо снижаются в момент включения ДОД практически до исходного, в горизонтальном положении, уровня.
Следует подчеркнуть, что в заданных экспериментальных условиях возникает ситуация, когда давление в верхней полой вене увеличивается в АОП и уменьшается при ДОД, а внутригрудное давление также снижается при ДОД, но в большей степени, чем венозное. В результате трансмуральное ЦВД увеличивается при сочетании АОП и ДОД. Эта ситуация аналогична динамике трансмурального ЦВД, наблюдаемой в реальном космическом полете. Поэтому сочетание АОП и ДОД можно считать более адекватной гемодинамической моделью, чем антиортостатическая или иммерсионная модели.
Таким образом, полученные нами результаты позволяют провести соизмеримые физиологические параллели между респираторными и сердечно-сосудистыми реакциями, возникающими как при одиночном спонтанном вдохе, так и при постоянном дыхании под отрицательным давлением, что дает основание для заключения о физиологичности и приемлемости ДОД в качестве метода коррекции аниортостатического перераспределения региональных объемов крови, в частности, увеличенного кровенаполнения сосудистой системы головы.
Этот положительный профилактический эффект может быть усилен комплексным применением дыхания под отрицательным давлением и воздействия отрицательного давления на нижнюю часть тела (ОДНТ).
Такая комбинация может быть использована для моделирования орто-статической нагрузки в условиях невесомости с экспертной и прогностической целью и с целью тренировки сердечно-сосудистой системы для профилактики ортостатических расстройств на заключительном этапе полета.
Таким образом, результаты проведенных в нашей лаборатории исследований кратко можно резюмировать следующим образом. Дискретное применение ДОД у людей в антиортостатическом положении обеспечивает трансформацию гемодинамических показателей головы и шеи до уровней, близких соответствующим горизонтальному положению тела.
Комплексное применение ДОД и ОДНТ имеет аддитивный характер, обеспечивающий приближение гемодинамических показателей к характерным для вертикального положения тела.
4. Перспектива исследований системы дыхания в невесомости
Исследования газоэнергообмена и системы внешнего дыхания применительно к условиям космического полета являются актуальными с многих точек зрения.
Во-первых, разработка новых и усовершенствование существующих систем, обеспечивающих близкий к естественному газовый состав атмосферы космических кораблей и станций, температуру и влажность окружающей среды, питание космонавтов, невозможна без получения информации об энергетических тратах, количестве необходимого кислорода, выделенного углекислого газа, тепла и влаги.
Во-вторых, сведения об энерготратах необходимы для решения эргономических вопросов, рационального построения режима труда и отдыха космонавтов.
В-третьих, поддержание высокого уровня работоспособности человека, находящегося в условиях невесомости, и определение его функциональных резервов неразрывно связано с оценкой двигательной активности, объема выполняемой работы, в частности, энергетической стоимости физических упражнений.
И наконец, актуальность исследований системы внешнего дыхания и газообмена определяется необходимостью совершенствования системы медицинского контроля за состоянием здоровья космонавтов. Нельзя получить достаточно полное представление о состоянии здоровья, не зная состояния функции дыхания.
Учитывая не оставляемые человеком попытки расширить свое жизненное пространство, включая пребывание на других планетах, комплексное исследование функциональной системы дыхания в космических полетах становится необходимым.
Цели ближайших исследований, включая исследования на Международной космической станции, можно сформулировать следующим образом:
-
уточнение роли респираторной системы в формировании полетного и послеполетного состояния здоровья космонавтов;
-
разработка методологии оценки состояния системы дыхания применительно к особенностям медицинского обеспечения космических экспедиций;
-
разработка рекомендаций по совершенствованию системы профилактики возможных неблагоприятных изменений респираторной системы в космическом полете.
Ключевыми проблемами на данном этапе развития космической физиологии и медицины требующими решения, являются:
-
система дыхания и физическая детренированность;
-
система дыхания и ортостатическая неустойчивость;
-
регуляция дыхания в невесомости;
-
гипоксемия и механизмы ее возникновения.
Направления исследований – традиционные для нормальной физиологии дыхания:
-
биомеханика дыхания;
-
легочный газообмен;
-
легочная гемодинамика;
-
функциональное состояние дыхательных мышц;
-
нервная регуляция дыхания;
-
гуморальная регуляция дыхания;
-
кислотно-основное состояние крови.
В настоящее время заканчивается создание аппаратуры, позволяющей исследовать ряд вопросов, решение которых приблизит нас и к решению проблем, перечисленных выше. Это, прежде всего, аппаратура для эксперимента «Дыхание-1», начало которого на российском сегменте МКС планируется с 2007 года и прибор «Пневмокард».
В процессе эксперимента «Дыхание-1» будут исследоваться легочные объемы; торакоабдоминальные компоненты дыхания; усилия, развиваемые дыхательными мышцами; регуляция дыхания и, в частности, регуляция произвольной составляющей дыхания. При помощи прибора «Пневмокард» можно будет исследовать кардиопульмональные отношения. Доставка «Пневмокарда» на МКС планируется на конец 2006 года. Вместе с тем идеальным вариантом, было бы комплексное исследование системы дыхания в длительном космическом полете по всем тем направлениям, которые упоминались выше. Проект такой программы у нас готов, но для ее реализации необходимо разработать часть недостающей аппаратуры, в частности, газоанализатор. Остается только работать.
ЗАКЛЮЧЕНИЕ
В результате многолетних исследований доказано, что в космическом полете в результате увеличения кровенаполнения грудной клетки, отсутствия гравитационных воздействий на легкие, веса органов брюшной полости, изменения тонуса мышц происходят характерные изменения внешнего дыхания:
-
уменьшаются жизненная и функциональная емкость легких, дыхательный объем, резервный объем выдоха;
-
увеличивается резервный объем вдоха;
-
уменьшается величина таких показателей форсированного дыхания как форсированная жизненная емкость легких, объем форсированного выдоха за первую секунду, мгновенная объемная скорость потока на разных уровнях ЖЕЛ, максимальная вентиляция легких.
Выявлена связь между степенью изменений показателей внешнего дыхания космонавтов и продолжительностью полета.
Показано, что уровень напряжения кислорода в капиллярной крови, измеренный непрямыми и прямыми методами, в космическом полете ниже, чем на Земле. Установлено, что трансформация эластических характеристик дыхательного аппарата, которая возникает под влиянием измененного внутригрудного давления, приводит к инверсии естественных соотношений транспульмонального, внутригрудного и центрального венозного давления, преимущественно определяющих величину давления наполнения правого предсердия.
Результаты исследований подтверждают гипотезу о развитии детренированности дыхательных мышц под влиянием факторов космического полета. Снижение функционального резерва мощности системы внешнего дыхания наряду с детренированностью сердечно-сосудистой системы и скелетной антигравитационной мускулатуры могут являться причинами снижения аэробной физической работоспособности и ортостатической неустойчивости. Основным механизмом обнаруженных респираторных эффектов является функциональная недостаточность диафрагмы, вызванная ухудшением ее сократительной способности и нарушением связи между процессами возбуждения и сокращения в мышечных волокнах диафрагмы.
На основании этого заключения можно сделать вывод о целесообразности использования в дополнение к существующим средствам и методам профилактики снижения физической работоспособности и ортостатической устойчивости, разработанных в нашей лаборатории средств для поддержания оптимального физиологического статуса дыхательных мышц (изделие «Жилет») и моделирования ортостатической нагрузки в невесомости (дыхание под отрицательным давлением) с целью дополнительной тренировки сердечно-сосудистой системы.
В заключение я хочу выразить искреннюю благодарность моим коллегам, сотрудникам лаборатории «Внешнего дыхания и газоэнергообмена», с которыми мы на протяжении многих лет работали над проблемой дыхания в невесомости: Н.М.Асямоловой, М.Ю.Волкову, Ю.Г.Дорофееву, Г.Э.Савченко, К.С.Хайдакову, А.П.Яцыку Нашим помощницам: В.Н.Волковой, Е.В.Горбачевой, С.Н.Фединой.
Добрым словом вспоминаю К.С.Юрову и Р.И.Финогенову. Я особенно благодарен, как сейчас принято говорить, «ключевому персоналу» лаборатории: Александру Николаевичу Котову, с кем мы вместе создавали лабораторию, Михаилу Алексеевичу Тихонову и Владимиру Ивановичу Колесникову, высококвали-фицированным и преданным делу специалистам, на ком фактически сейчас держится «дыхательная» тематика.
Я признателен сотрудникам Института, поддержавшим лабораторию в трудное для нее время: А.И.Дьяченко, Ю.А.Шулагину, И.А.Ничипоруку. Мне приятно сознавать, что в нашей лаборатории работали ученые, ставшие впоследствии руководителями самостоятельных направлений: В.П.Катунцев, Б.Н.Павлов.
Хочу сказать слова благодарности нашим коллегам из других организаций, участвовавшим в решении проблем космической пульмонологии.
Исследования биомеханики дыхания мы проводили совместно с лабораторией «Клинической физиологии дыхания» Института пульмонологии г. Санкт-Петербурга (Р.Ф.Клемент, В.К.Кузнецова, Ю.М.Котегов). Именно в процессе обсуждения некоторых пульмонологических больных с Вандой Константиновной Кузнецовой родилась идея о возможном снижении резервных возможностей диафрагмы в космическом полете. В Московском институте пульмонологии, возглавляемом академиком РАМН А.Г.Чучалиным, проводились исследования ряда заболеваний легких как моделей эффектов невесомости на респираторную систему.
Мы активно работаем с лабораторией «Физиологии дыхания» Института физиологии РАН (Н.П.Александрова, Ж.А.Донина) по изучению механизмов влияния невесомости на систему дыхания в космическом полете. Совместно с кафедрой анатомии и физиологии Тверского Государственного университета (В.И.Миняев, А.В.Миняева) готовим эксперимент «Дыхание-1» для исследования регуляции дыхания в невесомости. Продолжаем проводить испытания новых средств и методов тренировки дыхательных мышц и повышения их работоспособности совместно с сотрудниками Волгоградской Академии физической культуры (И.Н.Солопов).
Проводить эксперименты в космическом полете невозможно без специально разработанной или приспособленной для этих целей аппаратуры. Наша благодарность специалистам Комплекса главного конструктора В.И.Кожаринову, подготовившему совместно с коллегами из ГДР (Хаазе, Кениг, Haake) аппаратуру для исследования функции дыхания космонавтов на орбитальных станциях «Салют-6» и «Мир», В.А.Грачеву, участвующему в разработке приборов для МКС.
Я благодарен судьбе за то, что, придя в 1969 году в Институт, был сразу вовлечен в программу подготовки длительных космических полетов. Я оказался в коллективе умных, талантливых, инициативных людей, умеющих находить решения в трудных ситуациях, не боящихся принимать решения и делающих все возможное для их выполнения.
Это ли не Школа?! Спасибо моему первому учителю в Институте Юрию Герасимовичу Нефедову. Спасибо Абраму Моисеевичу Генину, благодаря которому я реально ощутил существование понятия «научная школа».
Я продолжаю учиться у Олега Георгиевича Газенко. Общение с Олегом Георгиевичем приносит не только энциклопедические знания, но и истинное удовольствие. Какое умение сформулировать научную задачу и осветить научную проблему! Какая логика! Какая мудрость!
Учить можно по-разному. По моему мнению, наиболее эффективным способом обучения является обучение делом, обучение личным примером. Для меня таким примером, начиная с аспирантуры был и остается Анатолий Иванович Григорьев. Невозможно было бы проработать столько лет вместе без взаимопонимания и поддержки.
Я счастлив, что, будучи вовлеченным 37 лет назад в программу подготовки длительных космических орбитальных полетов, сейчас имею возможность что-то сделать и для межпланетных миссий.
Хотелось бы, чтобы для наших молодых ученых и специалистов эксперимент «Марс-500» явился бы школой, позволившей им получить новые знания и опыт для обеспечения реального полета Человека к Марсу.
Dum spiro, spero!
| <<<
Другие доклады |
|

